σ軌域
外观
(重定向自Σ轨道)

在化學與原子物理學中,σ軌域(英語:σ orbital、sigma orbital)是一種分子軌域。是形成σ鍵後所產生的分子軌域。
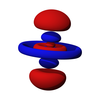
σ軌域是一種由軌域端對端重疊所形成的新軌域。重疊的軌域可以是s軌域如H2,也可以是p軌域,如F2。
結構
[编辑]
σ軌域是兩個原子的s軌域或兩個原子pz軌域相互作用結果,如果軌域相對於連接兩個核中心,核間軸的軸線是對稱的。這意味著,分子軌域的旋轉與核間軸不會導致相位變化有關。
σ*軌域
[编辑]σ*軌域是σ軌域的反鍵軌域,當核軸轉時也有相同的相位。σ*軌域有一個波節,其位於原子核與核軸間的垂直平面。[1]
表示法
[编辑]將形成此軌域原來的軌域寫在σ後面並下標,例如σ1s軌域是從原子的1s軌域鍵結所形成的。此外,如果組合得到的分子軌域能量比組合前原子軌域能量之和高,即原子核間電子雲密度減小,則稱作反鍵軌域,以*標註,計為σ*軌域。此外,兩個原子核的中點對於對稱σ軌域為σg軌域,以σu代表反對稱的σ軌域。
σ鍵
[编辑]σ鍵是價鍵理論和分子軌域理論中一種化學鍵的名稱。由兩個相同或不相同的原子軌域沿軌道對稱軸方向相互重疊而形成的共價鍵,叫做σ鍵。一般的「單鍵」都屬於這種σ鍵,所形成的軌域則為σ軌域,比如C-H, O-H, N-H, C-C, C-Cl等等。
參見
[编辑]參考文獻
[编辑]- ^ Catherine E. Housecroft, Alan G, Sharpe, Inorganic Chemistry, Pearson Prentice Hall; 2nd Edition, 2005, p. 29-33.