电环化反应
电环化反应是周环反应的一类,反应中共轭体系两端的原子环合形成新的σ键,形成比原来分子少一个π键的产物。它的逆反应也属于电环化反应,有时为了区分,将前者成环反应称为“电环合反应”。[1]电环化反应是立体选择性的反应,通常使用的反应底物是环烯烃和对应的共轭烯烃。它于1960年前后被发现。

为了使π电子环合成为σ键,烯烃末端碳原子的键必须旋转,而旋转的方向可以是两个键朝同一方向旋转,或两个键朝不同方向旋转,分别称为顺旋和对旋。顺旋又可分为顺时针顺旋和反时针顺旋两种,对旋又可分为内向对旋和外向对旋两种,但这个因素一般很少考虑。
根据分子轨道对称守恒原理,为了发生电环化反应,共轭烯烃HOMO两端的两个p轨道必须发生同位相的重叠。由于链形烯烃总π电子数会对HOMO的对称性造成影响,加热或光照也会使分子轨道能级图上的电子排布发生改变,因此电环化反应存在以下选择性的规则,可用于预测某一反应的产物:
| 链形共轭烯烃的π电子数 | 4n+2 | 4n | ||
|---|---|---|---|---|
| 顺旋 | Δ | hν | Δ | hν |
| 禁阻 | 允许 | 允许 | 禁阻 | |
| 对旋 | Δ | hν | Δ | hν |
| 允许 | 禁阻 | 禁阻 | 允许 | |
| 注:“允许”指“对称性允许”,“禁阻”指“对称性禁阻”。 | ||||
光照时HOMO一个电子被激发到LUMO上去,使得反应的选择性颠倒,禁阻变为允许,允许变为禁阻。以上规则只表明反应按照协同反应机理进行时的活化能高低,并不排除反应按照其他机理进行。
电环化反应是可逆反应,正逆反应途径是相同的,因此需要注意基态时,反应平衡朝哪一个方向进行更为有利。
苯并环丁烷发生的电环化反应是电环化反应中研究较多的一类。以下图为例,苯并环丁烷加热顺旋开环,生成一个具有类醌结构的不稳定的双烯体。它可以和强亲双烯体(如顺丁烯二酸酐)发生狄尔斯-阿尔德反应生成内型的加合物。苯并环丁烷的开环反应产率因此与取代基R具有很大的关系,[2]例如,在110°C和甲苯作溶剂的条件下,随着R由甲基、异丁基甲基变为三甲基硅基甲基,产率也随着上升。

Nazarov成环反应是二乙烯基酮环化成为环戊烯酮的电环化反应。很多带正电荷或负电荷的共轭烯烃也可以发生电环化反应,比如,环丙烷正离子广义上也属于4n+2体系,因此也可以在加热时发生对旋开环,生成烯烃。
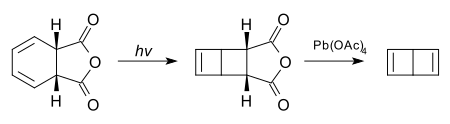
很多看上去张力很大的化合物,在光照条件下,受分子轨道对称性的限制实际上是稳定的。下面的化合物经过电环化反应与四乙酸铅处理,可以得到无取代的杜瓦苯: