電環化反應
電環化反應是周環反應的一類,反應中共軛體系兩端的原子環合形成新的σ鍵,形成比原來分子少一個π鍵的產物。它的逆反應也屬於電環化反應,有時為了區分,將前者成環反應稱為「電環合反應」。[1]電環化反應是立體選擇性的反應,通常使用的反應底物是環烯烴和對應的共軛烯烴。它於1960年前後被發現。

為了使π電子環合成為σ鍵,烯烴末端碳原子的鍵必須旋轉,而旋轉的方向可以是兩個鍵朝同一方向旋轉,或兩個鍵朝不同方向旋轉,分別稱為順旋和對旋。順旋又可分為順時針順旋和反時針順旋兩種,對旋又可分為內向對旋和外向對旋兩種,但這個因素一般很少考慮。
根據分子軌道對稱守恆原理,為了發生電環化反應,共軛烯烴HOMO兩端的兩個p軌道必須發生同位相的重疊。由於鏈形烯烴總π電子數會對HOMO的對稱性造成影響,加熱或光照也會使分子軌道能級圖上的電子排布發生改變,因此電環化反應存在以下選擇性的規則,可用於預測某一反應的產物:
| 鏈形共軛烯烴的π電子數 | 4n+2 | 4n | ||
|---|---|---|---|---|
| 順旋 | Δ | hν | Δ | hν |
| 禁阻 | 允許 | 允許 | 禁阻 | |
| 對旋 | Δ | hν | Δ | hν |
| 允許 | 禁阻 | 禁阻 | 允許 | |
| 註:「允許」指「對稱性允許」,「禁阻」指「對稱性禁阻」。 | ||||
光照時HOMO一個電子被激發到LUMO上去,使得反應的選擇性顛倒,禁阻變為允許,允許變為禁阻。以上規則只表明反應按照協同反應機理進行時的活化能高低,並不排除反應按照其他機理進行。
電環化反應是可逆反應,正逆反應途徑是相同的,因此需要注意基態時,反應平衡朝哪一個方向進行更為有利。
苯並環丁烷發生的電環化反應是電環化反應中研究較多的一類。以下圖為例,苯並環丁烷加熱順旋開環,生成一個具有類醌結構的不穩定的雙烯體。它可以和強親雙烯體(如順丁烯二酸酐)發生狄爾斯-阿爾德反應生成內型的加合物。苯並環丁烷的開環反應產率因此與取代基R具有很大的關係,[2]例如,在110°C和甲苯作溶劑的條件下,隨着R由甲基、異丁基甲基變為三甲基矽基甲基,產率也隨着上升。

Nazarov成環反應是二乙烯基酮環化成為環戊烯酮的電環化反應。很多帶正電荷或負電荷的共軛烯烴也可以發生電環化反應,比如,環丙烷正離子廣義上也屬於4n+2體系,因此也可以在加熱時發生對旋開環,生成烯烴。
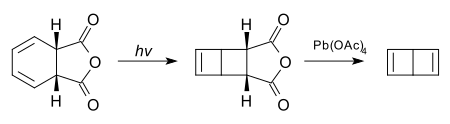
很多看上去張力很大的化合物,在光照條件下,受分子軌道對稱性的限制實際上是穩定的。下面的化合物經過電環化反應與四乙酸鉛處理,可以得到無取代的杜瓦苯: