2-碘酰基苯甲酸
| 2-碘酰基苯甲酸 | |||
|---|---|---|---|
| |||
| |||
| 别名 | IBX | ||
| 识别 | |||
| CAS号 | 61717-82-6 | ||
| PubChem | 339496 | ||
| ChemSpider | 300947 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | CQMJEZQEVXQEJB-UHFFFAOYAL | ||
| ChEBI | 52701 | ||
| 性质 | |||
| 化学式 | C7H5IO4 | ||
| 摩尔质量 | 280.02 g·mol⁻¹ | ||
| 危险性 | |||
| 警示术语 | R:R22, R34, R44 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
2-碘酰基苯甲酸(IBX)是典型的高价碘试剂,在有机合成中用作氧化剂,用于将醇氧化为醛。
制取
[编辑]以邻碘苯甲酸、溴酸钾(或过一硫酸氢钾复合盐[1])和硫酸为原料制取。[2]它在空气中稳定,可以长期保存。
历史
[编辑]该化合物于1893年被首先合成,但由于它在多数常见有机溶剂中的溶解性不好,它的应用最初并不是很广泛。1994年 Frigerio 发现它易溶于二甲基亚砜,对醇和邻二醇的氧化效果很好,从而揭开了IBX在有机合成中应用的新篇章。
以前曾认为IBX是易爆的,但它对震动的敏感性可能是由于其中有制备原料溴酸钾残留。商业品IBX中还含有苯甲酸和间苯二甲酸作稳定剂。
反应机理
[编辑]
IBX将醇氧化为醛的反应是经所谓超价扭转机理进行的,[3]包括配体交换(取代醇羟基)、扭转及消除三步。扭转一步中氧原子移至消除反应所需的五元环过渡态中。扭转的推动力是烷氧基的质子与芳环邻位质子间的位阻作用。因而与低级醇相比高级醇更容易被IBX氧化。计算也显示,如果将邻位质子换成甲基,则反应速率将提高至前者的100倍。
扭转这一步是反应的速控步且是必需的,否则碘-氧双键与烷氧基是非共平面的,协同消除无法发生。
IBX有两个互变异构体,其中一个是羧酸结构。IBX在水中的pKa为2.4,在DMSO中的pKa为6.65。[4]其酸性也会导致酸催化的异构化成为氧化的副反应。
应用
[编辑]IBX也可负载到硅胶或聚苯乙烯上。这些含IBX的聚合物与IBX相比具有分离简便、试剂可回收和无爆炸性等优点,且氧化性与IBX相似,可得较满意的结果。
IBX与乙酸和乙酸酐的混合液加热即得戴斯-馬丁氧化劑(DMP),后者更易溶于常见有机溶剂中,具有很广泛的应用。IBX在氧化反应方面常与DMP有相似的性质,不过DMP不稳定,不能长期保存。

2000年 K.C. Nicolaou 等人发现IBX可在加熱條件下實現醛酮化合物的脫氫反映,生成α,β-不飽和羰基化合物。[6]
氧化断裂
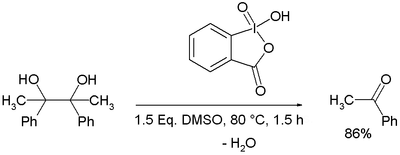
[编辑]例:IBX与DMSO连用,使邻二醇发生氧化断裂,生成酮:[7]
反应中首先生成10-I-4的IBX与DMSO的12-I-5的加合物(3),其中DMSO作离去基团。(3)与醇(4)反应得(5),排出DMSO。(5)发生分子内缩合,释出一分子水,产生12-I-5螺双环的高碘物(6),并进一步碎裂为(7)。存在羟基α质子时则酮醇为反应副产物。三氟乙酸对反应有促进作用。
参考资料
[编辑]- ^ Marco Frigerio, Marco Santagostino, and Simona Sputore. A User-Friendly Entry to 2-Iodoxybenzoic Acid (IBX) (abstract). J. Org. Chem. 1999, 64 (12): 4537–4538 [2010-08-01]. doi:10.1021/jo9824596. (原始内容存档于2020-11-05).
- ^ Robert K. Boeckman, Jr., Pengcheng Shao, and Joseph J. Mullins. Dess-Martin periodinane: 1,1,1-Triacetoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one [1,2-Benziodoxol-3(1H)-one, 1,1,1-tris(acetyloxy)-1,1-dihydro-]. Organic Syntheses. 2000, 77: 141 [2010-08-01]. (原始内容存档于2012-07-28). (also in the Collective Volume (2004) 10:696 (页面存档备份,存于互联网档案馆) (PDF)).
- ^ Julius T. Su and William A. Goddard III. Enhancing 2-Iodoxybenzoic Acid Reactivity by Exploiting a Hypervalent Twist (abstract). J. Am. Chem. Soc. 2005, 127 (41): 14146–14147 [2010-08-01]. PMID 16218584. doi:10.1021/ja054446x. (原始内容存档于2008-10-05).
- ^ Michael J. Gallen, Régis Goumont, Timothy Clark, François Terrier, Craig M. Williams. o-Iodoxybenzoic Acid (IBX): pKa and Proton-Affinity Analysis. Angewandte Chemie International Edition. 2006, 45 (18): 2929–2934. PMID 16566050. doi:10.1002/anie.200504156.
- ^ Debendra K. Mohapatra and Gorakhanath S. Yellol. Asymmetric total synthesis of eicosanoid. Arkivoc. [2010-08-01]. (原始内容存档于2007-12-13).
- ^ 邢其毅、裴偉偉、徐瑞秋、裴堅. 基礎有機化學 (第4版) 下冊 2017年8月第4次印刷. 北京市: 北京大學出版社. : 1068. ISBN 978-7-301-27943-4 (中文(中国大陆)).
- ^ Jarugu Narasimha Moorthy, Nidhi Singhal and Kalyan Senapati. Oxidative cleavage of vicinal diols: IBX can do what Dess–Martin periodinane (DMP) can't. Org. Biomol. Chem. 2007, 5 (5): 767–771. PMID 17315062. doi:10.1039/b618135j.