2-碘醯基苯甲酸
| 2-碘醯基苯甲酸 | |||
|---|---|---|---|
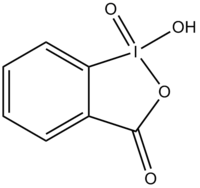
| |||
| |||
| 別名 | IBX | ||
| 識別 | |||
| CAS號 | 61717-82-6 | ||
| PubChem | 339496 | ||
| ChemSpider | 300947 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | CQMJEZQEVXQEJB-UHFFFAOYAL | ||
| ChEBI | 52701 | ||
| 性質 | |||
| 化學式 | C7H5IO4 | ||
| 莫耳質量 | 280.02 g·mol⁻¹ | ||
| 危險性 | |||
| 警示術語 | R:R22, R34, R44 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
2-碘醯基苯甲酸(IBX)是典型的高價碘試劑,在有機合成中用作氧化劑,用於將醇氧化為醛。
製取
[編輯]以鄰碘苯甲酸、溴酸鉀(或過一硫酸氫鉀複合鹽[1])和硫酸為原料製取。[2]它在空氣中穩定,可以長期保存。
歷史
[編輯]該化合物於1893年被首先合成,但由於它在多數常見有機溶劑中的溶解性不好,它的應用最初並不是很廣泛。1994年 Frigerio 發現它易溶於二甲基亞碸,對醇和鄰二醇的氧化效果很好,從而揭開了IBX在有機合成中應用的新篇章。
以前曾認為IBX是易爆的,但它對震動的敏感性可能是由於其中有製備原料溴酸鉀殘留。商業品IBX中還含有苯甲酸和間苯二甲酸作穩定劑。
反應機理
[編輯]
IBX將醇氧化為醛的反應是經所謂超價扭轉機理進行的,[3]包括配體交換(取代醇羥基)、扭轉及消除三步。扭轉一步中氧原子移至消除反應所需的五元環過渡態中。扭轉的推動力是烷氧基的質子與芳環鄰位質子間的位阻作用。因而與低級醇相比高級醇更容易被IBX氧化。計算也顯示,如果將鄰位質子換成甲基,則反應速率將提高至前者的100倍。
扭轉這一步是反應的速控步且是必需的,否則碘-氧雙鍵與烷氧基是非共平面的,協同消除無法發生。
IBX有兩個互變異構體,其中一個是羧酸結構。IBX在水中的pKa為2.4,在DMSO中的pKa為6.65。[4]其酸性也會導致酸催化的異構化成為氧化的副反應。
應用
[編輯]IBX也可負載到矽膠或聚苯乙烯上。這些含IBX的聚合物與IBX相比具有分離簡便、試劑可回收和無爆炸性等優點,且氧化性與IBX相似,可得較滿意的結果。
IBX與乙酸和乙酸酐的混合液加熱即得戴斯-馬丁氧化劑(DMP),後者更易溶於常見有機溶劑中,具有很廣泛的應用。IBX在氧化反應方面常與DMP有相似的性質,不過DMP不穩定,不能長期保存。

2000年 K.C. Nicolaou 等人發現IBX可在加熱條件下實現醛酮化合物的脫氫反映,生成α,β-不飽和羰基化合物。[6]
氧化斷裂
[編輯]例:IBX與DMSO連用,使鄰二醇發生氧化斷裂,生成酮:[7]
反應中首先生成10-I-4的IBX與DMSO的12-I-5的加合物(3),其中DMSO作離去基團。(3)與醇(4)反應得(5),排出DMSO。(5)發生分子內縮合,釋出一分子水,產生12-I-5螺雙環的高碘物(6),並進一步碎裂為(7)。存在羥基α質子時則酮醇為反應副產物。三氟乙酸對反應有促進作用。
參考資料
[編輯]- ^ Marco Frigerio, Marco Santagostino, and Simona Sputore. A User-Friendly Entry to 2-Iodoxybenzoic Acid (IBX) (abstract). J. Org. Chem. 1999, 64 (12): 4537–4538 [2010-08-01]. doi:10.1021/jo9824596. (原始內容存檔於2020-11-05).
- ^ Robert K. Boeckman, Jr., Pengcheng Shao, and Joseph J. Mullins. Dess-Martin periodinane: 1,1,1-Triacetoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one [1,2-Benziodoxol-3(1H)-one, 1,1,1-tris(acetyloxy)-1,1-dihydro-]. Organic Syntheses. 2000, 77: 141 [2010-08-01]. (原始內容存檔於2012-07-28). (also in the Collective Volume (2004) 10:696 (頁面存檔備份,存於網際網路檔案館) (PDF)).
- ^ Julius T. Su and William A. Goddard III. Enhancing 2-Iodoxybenzoic Acid Reactivity by Exploiting a Hypervalent Twist (abstract). J. Am. Chem. Soc. 2005, 127 (41): 14146–14147 [2010-08-01]. PMID 16218584. doi:10.1021/ja054446x. (原始內容存檔於2008-10-05).
- ^ Michael J. Gallen, Régis Goumont, Timothy Clark, François Terrier, Craig M. Williams. o-Iodoxybenzoic Acid (IBX): pKa and Proton-Affinity Analysis. Angewandte Chemie International Edition. 2006, 45 (18): 2929–2934. PMID 16566050. doi:10.1002/anie.200504156.
- ^ Debendra K. Mohapatra and Gorakhanath S. Yellol. Asymmetric total synthesis of eicosanoid. Arkivoc. [2010-08-01]. (原始內容存檔於2007-12-13).
- ^ 邢其毅、裴偉偉、徐瑞秋、裴堅. 基礎有機化學 (第4版) 下冊 2017年8月第4次印刷. 北京市: 北京大學出版社. : 1068. ISBN 978-7-301-27943-4 (中文(中國大陸)).
- ^ Jarugu Narasimha Moorthy, Nidhi Singhal and Kalyan Senapati. Oxidative cleavage of vicinal diols: IBX can do what Dess–Martin periodinane (DMP) can't. Org. Biomol. Chem. 2007, 5 (5): 767–771. PMID 17315062. doi:10.1039/b618135j.




