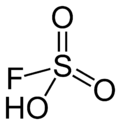
氟磺酸
外觀
| 氟磺酸 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 Sulfurofluoridic acid | |||
| 系統名 Fluorosulfuric acid[來源請求] | |||
| 別名 | 氟硫酸、氟代硫酸、 氟代磺酸 | ||
| 識別 | |||
| CAS號 | 7789-21-1 | ||
| PubChem | 24603 | ||
| ChemSpider | 23005 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | UQSQSQZYBQSBJZ-UHFFFAOYAW | ||
| UN編號 | 1777 | ||
| EINECS | 232-149-4 | ||
| RTECS | LP0715000 | ||
| MeSH | Fluorosulfonic+acid | ||
| 性質 | |||
| 化學式 | HFO3S | ||
| 摩爾質量 | 100.07 g·mol−1 | ||
| 外觀 | 無色液體 | ||
| 密度 | 1.84 g cm-3 | ||
| 熔點 | -87 °C(185.7 K) | ||
| 沸點 | 165 °C(438.5 K) | ||
| 溶解性(水) | 可溶 | ||
| pKa | -10 | ||
| pKb | 24 | ||
| 結構 | |||
| 配位幾何 | 四面體 | ||
| 分子構型 | 四面體 | ||
| 危險性 | |||
| 警示術語 | R:R20, R35 | ||
| 安全術語 | S:S1/2, S26, S45 | ||
| MSDS | ICSC 0996 | ||
| 歐盟編號 | 016-018-00-7 | ||
| 歐盟分類 | |||
| 相關物質 | |||
| 相關化學品 | 五氟化銻、三氟甲磺酸、 氫氟酸 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
氟磺酸(化學式:HSO3F),或稱氟代硫酸,是通用的強酸之一。其分子結構以HSO3F描述較恰當,可以強調它和硫酸(H2SO4)的關係。HSO3F是四面體型分子。
化學性質
[編輯]氟磺酸是流動性強的無色液體。它可溶於極性的有機溶劑中(例如硝基苯、醋酸和醋酸乙酯),但在非極性溶劑(如烷烴)中不易溶解。它強酸的性質,使它能溶解幾乎所有的有機化合物,甚至弱質子接受體(弱鹼)。[1] HSO3F會緩慢的水解為氟化氫與硫酸。
相關的三氟甲磺酸CF3SO3H保有HSO3F的強酸性,但不易水解。
製備
[編輯]- SO3 + HF → HSO3F
除此之外,用氟化氫鉀或氟化鈣與發煙硫酸在250°C反應,一旦產生HF,便以惰性氣體清除,HSO3F可在玻璃設備中分餾出來。[2]
超強酸
[編輯]HSO3F是結構簡單的布朗斯特酸中已知的最強酸之一,雖然碳硼烷酸酸性更強。[3] 它的酸度(H0)為−15.1,而硫酸是−12。HSO3F和路易斯酸五氟化銻混合會產生「魔酸」,這是一個超強的質子給予體。這些酸都歸類在「超強酸」中,酸度比純硫酸強。
應用
[編輯]HSO3F可以催化烷烴的異構化,及烯烴對烴的烷基化反應。[4] 它在實驗室也能作為氟化劑。[2]
安全性
[編輯]氟磺酸遇水解離出HF,有很強的毒性和腐蝕性。HSO3F加水會產生劇烈反應,如同硫酸加水一般。
參考資料
[編輯]- ^ Encyclopedia of Reagents for Organic Synthesis 2001 John Wiley & Sons, Ltd
- ^ 2.0 2.1 Cotton, F.A.; Wilkinson, G. (1980) Advanced Inorganic Chemistry: A Comprehensive Text, 4th Edition, p.246, Wiley-Interscience Publications.
- ^ M. Juhasz, S. Hoffmann, E. Stoyanov, K.-C. Kim, C. A. Reed, Angewandte Chemie International Edition 43 5352 - 5355 2004.
- ^ Olah, G.; Farooq, O.; Husain, A.; Ding, N.; Trivedi, N.; Olah, J. (1991) Superacid HSO3F/HF-Catalyzed Butane Isomerisation. Catalysis Letters 10, 239-248.