環氧化合物

環氧化(合)物(epoxide),是含氧三元環的醚類化合物,可以看作環氧乙烷的衍生物。其中三個原子大致在一個等邊三角形結構的平面上。由於張力較大,環氧化合物比其他醚更活潑,尤其是與親核試劑反應。簡單的環氧化合物可以通過它們的無氧完全飽和的母體結構來命名,比如環氧乙烷。

含有未反應環氧單元的聚合物稱為:聚環氧化物或者環氧樹脂。環氧樹脂可以用於膠粘劑和結構材料。聚合環氧化物可以得到聚醚,比如通過環氧乙烷經過聚合反應得到聚乙二醇。
合成
[編輯]工業中最主要的環氧化物是環氧乙烷和環氧丙烷,它們每年分別的產量分別約為1500萬和300萬噸。[1]乙烯的環氧化需要消耗的氧氣當量數如下:
- 7 H2C=CH2 + 6 O2 → 6 C2H4O + 2 CO2 + 2 H2O
氧氣和烯烴的直接反應僅對乙烯有效,其他烯烴甚至丙烯都不能直接反應。
烯烴環氧化
[編輯]大多數的環氧化合物都是通過烯烴與過氧化物(能給出單個氧原子的試劑)反應得到的。典型的過氧化物包括了過氧化氫(雙氧水)、過氧羧酸和烷基氫過氧化物。在一些特殊的應用中,其他的過氧化試劑也可以被使用,如:二甲基二氧丙環(DMDO)。
這類反應最廣泛應用於合成環氧丙烷,其使用叔丁基過氧化氫(過氧化叔丁基)或乙基苯基過氧化氫與丙烯反應。[2]實驗室內更為典型的過氧化反應是Prilezhaev反應。[3][4]反應使用過氧酸,如m-CPBA來氧化烯烴。圖例是利用過氧苯甲酸環氧化苯乙烯得到苯乙烯氧化物:[5]
反應是通過熟知的「蝴蝶機理」進行。[6]過氧化物被認為是一種親電試劑,而烯烴是一種親核試劑。
又如圖例如下:
機理如下所示:
氫過氧化物同樣用於不對稱選擇環氧化催化劑,比如Sharpless環氧化反應以及Jacobsen環氧化反應,在上述兩個反應中氧原子從金屬氧化物或者過氧化物被轉移到底物上。它們與史氏環氧化反應在不對稱手性環氧化物合成中應用廣泛。啞嗪試劑也可用來轉化烯烴成為過氧化物。
分子內SN2取代
[編輯]這個方法是Williamson合成的衍生方法。在這個例子當中:鹵代醇相鄰碳上處於反式的醇鹽負離子作為親核試劑和鹵素原子反應,鹵素負離子離去,生成環氧化合物。[7]

全球的大約一半的環氧丙烷就是通過這個方法製備的。[2]醛或酮在強鹼(如醇鈉、氨基鈉等)的作用下和一個α-鹵代羧酸酯進行Darzen反應,生成α,β-環氧酸酯,該人名反應的關鍵步驟就是該反應。在Johnson-Corey-Chaykovsky反應中,通過羰基基團和硫葉立德反應生成環氧化合物。在這個反應當中,硫代替了氯作為離去基團。
親核環氧化
[編輯]缺電子的烯烴,比如烯酮或者丙烯衍生物可以使用親核的含氧化合物比如過氧化物來進行環氧化反應。這個反應是兩步反應歷程,第一部是氧原子進行親核共軛加成反應得到一個穩定的碳負離子,然後碳負離子進攻相同的氧原子,取代一個離去基團並關環。
不對稱環氧化
[編輯]環氧化合物的碳原子是sp3-雜化的,而可能形成一個手性中心。環氧化產物有可能是順式或者反式的非對映體,這取決於反應的機理以及起始原料烯烴的立體化學。另外,如果在起始原料當中有其他的手性中心,那麼環氧化還會影響到環氧基附近的手性。這種反應的非對映選擇性是底物控制型的。最後,具有手性結構的環氧化試劑能夠影響到環氧化試劑的手性。(參見Sharpless環氧化,Jacobsen環氧化反應,和Juliá-Colonna環氧化)。反應的對映選擇性是試劑控制型的。
反應
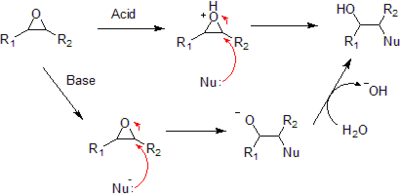
[編輯]環氧化物的典型反應如下:
- 對環氧化物的親核加成反應既可以是酸催化也可以是鹼催化。
- 在酸性條件下,親核試劑進攻環上可以讓其形成最穩定碳正離子的碳原子,比如說取代最多的碳原子。在鹼性條件下,親核試劑進攻位阻最小,也就是取代最少的碳原子,這個過程是標準的 SN2 親核加成反應。
參考資料
[編輯]- ^ Siegfried Rebsdat, Dieter Mayer "Ethylene Oxide" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.doi:10.1002/14356007.a10_117 Article Online Posting Date: March 15, 2001.
- ^ 2.0 2.1 Dietmar Kahlich, Uwe Wiechern, Jörg Lindner 「Propylene Oxide」 in Ullmann's Encyclopedia of Industrial Chemistry, 2002 by Wiley-VCH, Weinheim. doi:10.1002/14356007.a22_239Article Online Posting Date: June 15, 2000
- ^ March, Jerry. 1985. Advanced Organic Chemistry, Reactions, Mechanisms and Structure. 3rd ed. John Wiley & Sons. ISBN 0471854727.
- ^ Nikolaus Prileschajew. Oxydation ungesättigter Verbindungen mittels organischer Superoxyde. Berichte der deutschen chemischen Gesellschaft. 1909, 42 (4): 4811–4815. doi:10.1002/cber.190904204100.
- ^ Harold Hibbert and Pauline Burt (1941). "Styrene Oxide". Org. Synth.; Coll. Vol. 1: 494.
- ^ Bartlett Rec. Chem. Prog 1950, 11 47.
- ^ Koppenhoefer, B.; Schurig, V. (1993). "(R)-Alkyloxiranes of High Enantiomeric Purity from (S)-2-Chloroalkanoic Acids via (S)-2-Chloro-1-Alkanols: (R)-Methyloxirane". Org. Synth.; Coll. Vol. 8: 434.
- ^ K. Barry Sharpless, Martha A. Umbreit, Marjorie T. Nieh, Thomas C. Flood. Lower valent tungsten halides. New class of reagents for deoxygenation of organic molecules. J. Am. Chem. Soc. 1972, 94 (18): 6538–6540. doi:10.1021/ja00773a045.