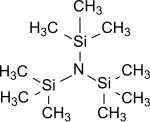
三(三甲基矽基)胺
| 三(三甲基矽基)胺 | |
|---|---|
| |
| IUPAC名 1,1,1-Trimethyl-N,N-bis(trimethylsilyl)silanamine | |
| 別名 | 九甲基三矽氮烷 |
| 識別 | |
| CAS號 | 1586-73-8 |
| PubChem | 74110 |
| ChemSpider | 66724 |
| SMILES |
|
| EINECS | 216-445-0 |
| 性質 | |
| 化學式 | C9H27NSi3 |
| 摩爾質量 | 233.57 g·mol⁻¹ |
| 外觀 | 蠟狀固體 |
| 熔點 | 67–69ºC |
| 沸點 | 215ºC(85ºC當13mmHg) |
| 溶解性 | 易溶於非極性溶劑如:苯、四氯甲烷、乙醚、1,4-二氧六環、石油醚[1]和四氫呋喃[2] |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
三(三甲基矽基)胺是氨的所有氫原子都被三甲基矽基 (-Si(CH3)3)取代而成的化合物。[1]三(三甲基矽基)胺在多年來一直都是研究熱點,因為它可作為化學固氮(在標準情況下把氮氣 N2轉化成有機化合物)的穩定中間體。[3][4][5]
製備
[編輯]早期嘗試製備三(三甲基矽基)胺的方法是三甲基氯矽烷和氨的反應,但即便再500 °C的高溫下,反應也未能成功。[6][7]這個反應在雙(三甲基矽基)胺時就停止了。

三(三甲基矽基)胺是從二(三甲基矽基)胺的鈉鹽製備的,後者則是二(三甲基矽基)胺和氨基鈉[8]或是二(三甲基矽基)胺、鈉和苯乙烯反應而成的。[1]這種鈉鹽和三甲基氯矽烷反應可得到三(三甲基矽基)胺,產率 80%。[9]
二(三甲基矽基)胺的鋰鹽(可由二(三甲基矽基)胺和丁基鋰[10]或苯基鋰[9]反應而成)和三甲基氯矽烷的反應,產生三(三甲基矽基)胺的產率為 50-60%。
氮化鋰和三甲基氯矽烷在 THF 的一鍋法反應的產率為 72%。[2]
性質
[編輯]三(三甲基矽基)胺是一種無色晶體[11][12]或蠟狀固體,[8]對水和鍵穩定。[13]醇和酸會斷裂Si-N鍵,放出氨。[8]
應用
[編輯]作為合成結構單元
[編輯]三(三甲基矽基)胺和三氯化銻反應,幾乎可以在-60 °C下形成氮化銻類立方烷簇合物。[14]
在P4-t-Bu和三(三甲基矽基)胺存在下,酮可以在溫和條件下三氟甲基化。使用惰性的三氟甲烷(HCF3,HFC-23)三氟甲基化,產率高達84%。[15]
單體三氯(三甲基矽基)磷氮烯 Cl3P=NSiMe3 可以由三(三甲基矽基)胺和五氯化磷在 0 °C的己烷反應而成,

這種單體可以聚合成聚(二氯磷氮烯),它具有確定的分子量和分散性。[16]
三氟化氮 NF3(用於矽晶片的等離子蝕刻)可以由三(三甲基矽基)胺和氟氣在–40 °C 的乙腈反應而成。反應抑制了氮氣和四氟肼的產生,它們是從氨或氟化銨合成三氟化氮的過程中,作為不良的副產物產生的。[17]

化學固氮
[編輯]哈伯-博施法使固氮成為可能。在高溫(>400°C)、高壓(>150 bar)和鐵催化劑存在下,氮氣可以被還原質子化成氨。在化學固氮(即在正常條件下將大氣中的氮氣轉化為化學合成的反應性原料,通常還有氨)中,三(三甲基矽基)胺在所謂的還原性甲矽烷基化中起着重要作用,因為它的水解會產生氨。
早在1895年,人們就發現鋰在室溫下就會和氮氣反應,形成氮化鋰。[18]1972年,K. Shiina 觀察到了鋰(作為電子給體)在三甲基氯矽烷和三氯化鉻催化下和氮氣反應,形成三(三甲基矽基)胺。[3]
最近發現N2的還原性甲矽烷基化反應中,可以用鈉代替鋰,然後用鉬[19]和鐵化合物[4](像是五羰基鐵或二茂鐵類[20])作催化劑。催化劑中的每個鐵原子可以催化高達34個 N(Me3Si)3分子。
使用鉬-二茂鐵配合物作為催化劑,翻轉數可高達 226。[21]
儘管進行了深入的研究,[22]迄今為止開發的化學固氮催化劑的催化生產率仍比現代的茂金屬型聚合催化劑或酶小。
參考資料
[編輯]- ^ 1.0 1.1 1.2 J. Goubeau, J. Jiminéz-Barberá, Tris-(trimethylsilyl)-amin, ZAAC 303 (5–6), 1960, 303 (5–6): 217–226, doi:10.1002/zaac.19603030502 (德語)
- ^ 2.0 2.1 W.L. Lehn, Preparation of tris(trimethylsilyl)- and tris(trimethylstannyl)amines, J. Am. Chem. Soc. 86 (2), 1964, 86 (2): 305, doi:10.1021/ja01056a057
- ^ 3.0 3.1 K. Shiina, Reductive silylation of molecular nitrogen via fixation to tris(trimethylsilyl)amine, J. Am. Chem. Soc. 94 (26), 1972, 94 (26): 9266–9267, doi:10.1021/ja00781a068
- ^ 4.0 4.1 K.C. MacLeod, P.L. Holland, Recent developments in the homogeneous reduction of dinitrogen by molybdenum and iron, Nature Chemistry 5, 2013, 5: 559–565, PMC 3868624
 , PMID 23787744, doi:10.1038/nchem.1620
, PMID 23787744, doi:10.1038/nchem.1620
- ^ W.I. Dzik, Silylation of dinitrogen catalyzed by hydridodinitrogen(triphenylphosphine) cobalt (I), Inorganics 4 (3), 2016, 4 (3): 21, doi:10.3390/inorganics4030021

- ^ R.O. Sauer, Derivatives of the methylchlorosilanes. I. Trimethylsilanol and its simple ethers, J. Am. Chem. Soc. 66 (10), 1944, 66 (10): 1707–1710, doi:10.1021/ja01238a030
- ^ R.O. Sauer, R.H. Hasek, Derivatives of the methylchlorosilanes. IV. Amines, J. Am. Chem. Soc. 68 (2), 1946, 68 (2): 241–244, doi:10.1021/ja01206a028
- ^ 8.0 8.1 8.2 C.R. Krüger, H. Niederprüm, M. Schmidt, O. Scherer, H.F. Holtzlow , 編, Sodium Bis(trimethylsilyl)amide and Tris(trimethylsilyl)amine, in Inorganic Syntheses 8, Hoboken, NJ, USA: John Wiley & Sons, Inc.: 15–19, 1966, ISBN 9780470131671, doi:10.1002/9780470132395.ch5
- ^ 9.0 9.1 U. Wannagat, H. Niederprüm, Beiträge zur Chemie der Silicium-Stickstoff-Verbindungen, XIII. Silylsubstituierte Alkaliamide, Chem. Ber. 94 (6), 1961, 94 (6): 1540–1547, doi:10.1002/cber.19610940618 (德語)
- ^ E.H. Amonoo-Neizer, R.A. Shaw, D.O. Skovlin, B.C. Smith, J.W. Rosenthal, W.L. Jolly, H.F. Holtzlow , 編, Lithium Bis(trimethylsilyl)amide and Tris(trimethylsilyl)amine, in Inorganic Syntheses 8, Hoboken, NJ, USA: John Wiley & Sons, Inc.: 19–22, 1966, ISBN 9780470131671, doi:10.1002/9780470132395.ch5
- ^ 來源:Sigma-Aldrich Co., product no. 360120 (28. Dezember 2016查閱).
- ^ Datenblatt Nonamethyltrisilazane bei AlfaAesar, abgerufen am {{{Abruf}}}.
- ^ U. Wannagat, H. Niederprüm, dreifach silylierte Amine, ZAAC 308 (1–6), 1961, 308 (1–6): 337–351, doi:10.1002/zaac.19613080135 (德語)
- ^ M. Rhiel, F. Weller, J. Pebler, K. Dehnicke, [SbN(SbCl)3(NSbCl2)(NSiMe3)3·SbCl3], ein ungewöhnlicher Nitridoantimonkomplex mit Heterocubanstruktur, Angew. Chem. 106 (5), 1994, 106 (5): 599–600, doi:10.1002/ange.19941060519 (德語)
- ^ S. Okusu, K. Hirano, E. Tokunaga, N. Shibata, Organocatalyzed trifluormethylation of ketones and sulfonyl fluorides by fluoroform under a superbase system, ChemistryOpen 4, 2015, 4: 581–585, PMC 4608523
 , PMID 26491635, doi:10.1002/open.201500160
, PMID 26491635, doi:10.1002/open.201500160
- ^ US 5698664,「Synthesis of polyphosphazenes with controlled molecular weight and polydispersity」
- ^ US 8163262,「Method for production of nitrogen fluoride from trimethylsilylamines」
- ^ H. Deslandres, Absorption de l’azote par le lithium à froid, Comptes rendus 121, 1895, 121: 886–887 [2021-08-10], (原始內容存檔於2021-04-29)
- ^ Q. Liao, N. Saffon-Merceron, N. Mézailles, N2 reduction into silylamine at tridentate phosphine/Mo center: catalysis and mechanistic study, ACS Catal. 5 (11), 2015, 5 (11): 6902–6906, doi:10.1021/acscatal.5b01626
- ^ M. Yuki, H. Tanaka, K. Sasaki, Y. Miyake, K. Yoshizawa, Y. Nishibayashi, Iron-catalyzed transformation of molecular dinitrogen into silylamine under ambient conditions, Nature Communications 3, 2012, 3: 1254, doi:10.1038/ncomms2264

- ^ H. Tanaka; et al, Molybdenum-Catalyzed Transformation of Molecular Dinitrogen into Silylamine: Experimental and DFT Study on the Remarkable Role of Ferrocenyldiphosphine Ligands, J. Am. Chem. Soc. 133 (10), 2011, 133 (10): 3498–3506, doi:10.1021/ja109181n
- ^ Y. Nishibayashi, Recent progress in transition-metal-catalyzed reduction of molecular dinitrogen under ambient reaction conditions, Inorg. Chem. 54 (19), 2015, 54 (19): 9234–9247, doi:10.1021/acs.inorgchem.5b00881

![{\displaystyle {\begin{matrix}{}\\{\ce {[(CH3)3Si]2NH ->[+{\ce {NaNH2}}][-{\ce {NH3}}] NaN[Si(CH3)3]2 ->[+{\ce {ClSi(CH3)3}}][-{\ce {NaCl}}] N[Si(CH3)3]3}}\\{}\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78549476135b927dc95d6c81bc50de9b89e0b7ae)

![{\displaystyle {\ce {{N2}+{6e^{-}}->[{\ce {Catalyst:}}\ {\ce {Mo}},\ {\ce {Fe}},\ {\ce {Co}}]}}{\begin{cases}{\ce {->[{\ce {H+}}]}}&{\ce {2NH3}}\\{}\\{\ce {->[{\ce {R3Si-X}}][-\,{\ce {X-}}]}}&{\ce {2N(SiR3)3}}\end{cases}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7aa5ae0b13d71a31c97f22297303dee5ed50221a)
![{\displaystyle {\ce {N2 + 6Me3SiCl + 6}}\,{\color {NavyBlue}{\ce {Li}}}\ {\ce {->[{\ce {CrCl3}}] 2N(SiMe3)3 + 6}}\,{\color {NavyBlue}{\ce {Li}}}{\ce {Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7e5556a07b9c108214c4261b7694524d5af5665)
![{\displaystyle {\ce {N2 + 6Me3SiCl + 6}}\,{\color {Red}{\ce {Na}}}\ {\ce {->[{\ce {Fe-catalyst}}] 2N(SiMe3)3 + 6}}\,{\color {Red}{\ce {Na}}}{\ce {Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ecf55c39b3edb4a67900c2fb80e508b6a1b31d91)
![{\displaystyle {\color {Red}{\ce {N2}}}+{\color {NavyBlue}{\ce {Me3Si}}}{\ce {{Cl}+Na->[{\ce {Mo/Fe-catalyst}}.][{\ce {RT}} \atop (1\ {\ce {atm}})]}}\ {\color {Red}{\ce {N}}}{\color {NavyBlue}{\ce {(Me3Si)3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e5a412bc2fab4fa67528a1779b7c318068be6f7)