瀰漫性毒性甲狀腺腫
此條目需要補充更多來源。 (2020年5月18日) |
| 瀰漫性毒性甲狀腺腫 | |
|---|---|
| 又稱 | Flajani–Basedow–Graves disease |
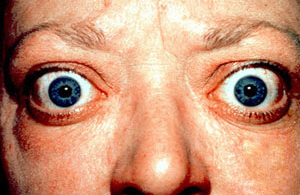 | |
| 患者出現典型的眼球凸出徵狀 | |
| 類型 | 甲狀腺功能亢進症、疾病 |
| 分類和外部資源 | |
| 醫學專科 | 內分泌學 |
| ICD-9-CM | 242.00 |
| OMIM | 275000 |
| MedlinePlus | 000358 |
| eMedicine | 120619、920283 |
瀰漫性毒性甲狀腺腫(英語:Toxic diffuse goiter),又稱葛瑞夫茲氏病(英語:Graves' disease),為一種主要侵犯甲狀腺的自體免疫性疾病[1]。此病為導致甲狀腺功能亢進症最常見的原因[2],且會導致甲狀腺腫。徵狀及徵象可能包含急躁易怒、肌肉無力、睡眠障礙、心跳過速、怕熱、腹瀉,以及體重減輕。其他徵狀可能包含脛前皮膚增厚,以及葛瑞夫茲氏眼病變造成的眼球凸出。約25%至80%的患者有眼睛相關的徵狀[1][3]。
目前造成此病的機制仍未明朗,可能與遺傳或環境因素有關[4]。家族中有罹患該病者的罹病概率較大[1]。若雙胞胎其中一人罹病,另一人罹病概率可能高達30%[5]。該疾病的發作原因可能包含壓力、感染,或是分娩[3]。患有其他自體免疫疾病者如一型糖尿病或類風濕性關節炎罹患此病的概率也較高。抽煙會增加罹病概率,且可能使眼部疾病惡化。造成瀰漫性毒性甲狀腺腫的自體抗體稱為甲狀腺刺激免疫球蛋白(thyroid stimulating immunoglobulin,TSI),與促甲狀腺激素(TSH)功能相仿。TSI會導致甲狀腺製造過多甲狀腺激素。該疾病能透過血液檢測與碘同位素的吸收狀況來檢測[1]。通常血液測試會發現血中T3和T4升高,TSH則下降,碘同位素攝取量及TSI則上升[3]。
治療方法有三種:碘-131、藥物,以及甲狀腺手術。放射治療會讓患者口服碘-131,由於甲狀腺具有濃縮碘的功能,藉此殺死過盛的甲狀腺。摧毀甲狀腺後所造成的甲狀腺機能低下症需藉由額外補充甲狀腺激素治療。其他治療藥物包含β受體阻滯劑,以及甲巰咪唑(methimazole)等甲狀腺抑制劑等可以緩解部分徵狀,另外也可以選擇手術移除甲狀腺。疾病造成的眼部問題需額外治療[1]。
瀰漫性毒性甲狀腺腫大約發生於0.5%的男性以及3%的女性[2],女性的發生率為男性的7.5倍[1]。疾病好發於40至60歲,但其實有可能發生於各年齡層[5]。該疾病在美國為甲狀腺機能亢進最主要的原因(約五至八成)[1][3]。該疾病的別名葛瑞夫茲氏病乃紀念1835年羅伯特·格里夫描述此疾病,但其實更早之前就有相關紀錄[5]。
歷史
[編輯]1825年Parry首次報告,1835年和1840年Graves和Basedow先後發表詳細報告,因此,本病被稱為「Parry病」、「Graves病」或「Basedow病」[6]。
流行病學
[編輯]好發於20~40歲,男女比例1:8。具有家族遺傳的傾向,可能與某些人類白細胞抗原表型有關。伴發其它自體免疫性疾病的風險增加。碘攝入量增加(如食用加碘鹽,胺碘酮治療等)亦增加Graves病患病率[7]。
病理學
[編輯]甲狀腺
[編輯]
- 大體觀:甲狀腺瀰漫對稱增大,表面光滑,質軟,包膜完整,切面呈分葉狀,顏色灰紅。為確保手術安全,術前常常採用碘劑等治療[8],此時,甲狀腺較治療前體積變小,質地變實。
- 鏡下觀:濾泡上皮組織肥大呈高柱狀,增生活躍,細胞彼此疊呈乳頭狀,並有小濾泡形成。上皮細胞周邊的膠質出現吸收空泡;濾泡腔內膠質變少、變稀薄,嚴重者膠質可消失。間質內毛細血管擴張、充血,淋巴細胞浸潤(以T細胞為主,伴少量B細胞和漿細胞),常伴生發中心形成。對於擇期手術切除的標本,受術前抗甲狀腺治療的影響,濾泡上皮細胞變矮,增生減輕;吸收空泡減少,膠質增多、增濃;間質中毛細血管充血減輕,淋巴細胞減少[9][10]。
甲狀腺外器官
[編輯]- 眶周出現大量糖胺聚糖沉積,淋巴細胞浸潤,纖維化;眼肌水腫,在疾病後期,可出現纖維化。
- 真皮糖胺聚糖沉積,淋巴細胞浸潤。
- 全身淋巴系統增生,胸腺、脾臟增大。
- 心臟肥大;可出現缺血性改變,尤其是合併冠心病時。
- 肝細胞變性、壞死,久病者肝組織纖維化,乃至肝硬化。
發病機制
[編輯]患者體內出現針對甲狀腺濾泡上皮細胞TSH受體的自體抗體,稱為「TSH受體抗體」(TSH receptor antibodies,TRAb)。根據TRAb與TSH受體結合後的效應,可以細分為:
- TSH受體刺激性抗體(TSH receptor stimulation antibody,TSAb):與TSH受體結合後,模擬TSH的效應,導致濾泡上皮細胞增生、功能亢進,是Graves病的致病抗體。
- TSH受體刺激阻斷性抗體(TSH receptor stimulation-blocking antibody,TSBAb):與TSH受體結合,自身沒有使TSH受體激動的能力,反而阻斷TSH或TSAb與受體的結合,因此,最後的結果是甲狀腺萎縮,功能降低。
此外,機體還存在針對甲狀腺的其他自體抗體。
Graves病出現突眼的原因可能有:
- 單純性突眼:甲狀腺毒症導致交感神經興奮性增高。
- Graves眶病(舊名:Graves眼病):針對濾泡上皮細胞的T細胞可能與眼球球後組織有交叉反應性,在T細胞分泌的細胞因子作用下成纖維細胞分泌過多黏多糖,並導致纖維化。
臨床表現
[編輯]典型表現
[編輯]- 瀰漫性甲狀腺腫:大部分患者有程度不等的瀰漫性、對稱性甲狀腺腫,質地不等,無壓痛。甲狀腺上下極可觸及震顫,聞及血管雜音,反映血流量增加。少數病例甲狀腺不腫大,或呈不對稱性腫大。
- 甲狀腺毒症:神經系統、循環系統、消化系統功能亢進,高代謝綜合症等。
- 眼征(Graves眶病):
- 單純性突眼:包括輕度突眼(突眼度在 19 ~ 20 毫米),上瞼攣縮,Stellwag征,von Graefe征,Joffroy征,Mobius征。
- 浸潤性眼征:顯著突眼,眼球活動受限甚至固定,眼瞼水腫、閉合不全,結膜充血、水腫,角膜潰瘍,全眼炎甚至失明。
- 皮膚損害:白人多見,多發生於脛骨前下1/3處(故又名「脛前黏液性水腫」),也可見於足背、踝關節、肩部、手背或手術疤痕處,偶見於面部,多為對稱分佈。早期皮膚增厚、變粗,廣泛出現大小不得、邊界清楚的棕紅色、紅褐色或暗紫色斑塊或結節,表面及周圍皮膚可有毛髮增生、增粗、毛囊角化,伴感覺減退或過敏。後期皮損常融合,覆蓋灰色疣狀物,似象腿。
- 其它:
- 造血系統:淋巴細胞、單核細胞可增多。血小板生存時間降低,甚至可出現血小板減少。缺鐵性貧血。
- 骨骼肌:除甲狀腺毒症本身造成的甲狀腺毒性周期性癱瘓、甲亢性肌病外,還可能伴發同屬自體免疫性疾病範疇的重症肌無力。
- 腎上腺皮質激素:機體對皮質激素需求增強,在疾病早期腎上腺皮質功能活躍;在重症患者(尤其是甲狀腺風暴)時,常有腎上腺皮質功能相對或絕對不全。
- 指端粗厚(acropachy):指甲鄰近游離邊緣部分與甲床分離,指端軟組織腫脹,呈杵狀,掌指骨骨膜下新骨形成,多見於吸煙者。這一體徵本身不會給病人帶來明顯影響,然而,指端粗厚反映強烈的自體免疫(如TRAb滴度高),預示着皮膚損害和眶病反覆的風險很高[7]。
特殊情況
[編輯]亞臨床甲亢
[編輯]僅TSH水平下降而甲狀腺激素水平正常,對健康的影響有:
- 部分患者發展為臨床甲亢。
- 心血管系統處於高動力狀態。
- 骨質疏鬆。
需在2~4個月內複查,以確定TSH降低是一過性還是持續性。
甲狀腺風暴
[編輯]多種原因導致的甲狀腺毒症的急性加重。原有徵狀加重,並出現與疾病程度不相稱的高熱。可以危及生命,需要緊急處置。
妊娠期甲亢
[編輯]妊娠與甲亢的相互作用包括:
- 妊娠頭3個月,人絨毛膜促性腺激素水平達到高峰,其與TSH有一定的交叉反應,可以激動TSH受體,形成妊娠一過性甲狀腺毒症(gestational transient thyrotoxicosis,GTT)。
- 生理性免疫抑制作用隨妊娠時間延長而逐漸增強,Graves病可出現自發好轉。相反,產後隨着生理性免疫抑制的解除,Graves病易於發生。
- 妊娠期間甲狀腺素結合球蛋白水平增高,可引起總T4、總T3增高,此時診斷甲狀腺毒症,依賴於游離T4、游離T3和TSH。
- 妊娠期間,母體的基礎代謝率存在生理性增高,心血管負擔加重,此時若合併甲亢,則有疊加作用。
- 甲亢可引起流產、早產、死產、妊娠高血壓綜合症等。
- 母體的TSAb可透過胎盤,引起胎兒或新生兒甲亢。
甲狀腺毒症性心臟病
[編輯]- 心律不整:以房性異位心律多見,如房性期前收縮、心房顫動,可為陣發性,亦可為持續性,發生率大約是8%,男性更多見。由於甲狀腺激素具有正性傳導作用,因此,心房顫動時心室率較難控制[7]。某些抗心律不整藥(如胺碘酮),可影響甲狀腺功能[11]。
- 心臟擴大:病程長而病情重者可有心臟結構改變。如果沒有合併其它心臟疾病,在甲亢控制後多數可以恢復正常。
- 心臟衰竭:
- 年輕、無心臟基礎疾病的患者,主要是心功能無法滿足高動力的需要,並非泵衰竭,稱為「高排出量型心力衰竭」,隨着甲亢控制,心力衰竭可以恢復。
- 老年,合併心臟基礎疾病者,常常是泵衰竭。而且,心臟徵狀常常掩蓋甲狀腺毒症表現,因此,頑固性心力衰竭患者應常規行甲狀腺功能檢查。
輔助檢查
[編輯]- 自體抗體:TRAb陽性,並以TSAb活性為主。經治療後,如果患者的抗體滴度明顯下降乃至正常,此時停藥復發的可能性較小。此外,還可以出現低滴度的其它抗甲狀腺自體抗體,如抗甲狀腺自體抗體(TPOAb)、抗甲狀腺球蛋白抗體(TgAb)等。
- 甲狀腺激素測定:T4和/或T3水平升高,可明確存在甲狀腺毒症。如果患者不存在影響甲狀腺素結合蛋白的因素,那麼總T4和總T3的測定精度、穩定性和重複性優於游離T4和游離T3;如果合併影響甲狀腺素結合蛋白的因素,則參考游離T4和游離T3[6]。可伴有rT3水平升高。
- TSH測定:下降。如果僅有TSH水平下降而甲狀腺激素水平正常,應考慮亞臨床甲亢或危重患者合併甲亢[12]。
- 甲狀腺超聲檢查:瀰漫性或局灶性回聲減低,低回聲處血流信號增強;甲狀腺上動脈和腺體內動脈流速顯著加快、阻力降低。在放射性核素檢查受限制時,可藉助血流增快間接推斷甲狀腺功能亢進[13]。
- 131I攝取率:在診斷Graves病方面,已被TSH測定取代[6]。目前主要用於甲狀腺毒症的鑑別診斷(屬於甲亢的,131I攝取量增多,高峰前移;屬於非甲亢的,131I攝取率降低),以及計算131I治療時放射性同位素的劑量。
- 甲狀腺放射性核素掃描:主要用於鑑別多結節性毒性甲狀腺腫、甲狀腺自主高功能腺瘤。前者核素分佈不均勻,增強區和減弱區灶性分佈。而高功能腺瘤處核素富集,呈熱結節,其餘區域因受負反饋抑制而成冷結節。Graves病則均勻增強。近1~2個月內攝碘過多(如應用含碘造影劑、胺碘酮、食用海產品等),可能導致假性攝取下降;如未能追問到相應病史,或者病史有矛盾,可檢查尿碘濃度[13]。

診斷
[編輯]甲亢的診斷
[編輯]- 甲狀腺激素水平增高,TSH水平降低。
- 高代謝綜合症。
具備上述兩點即可明確甲亢。需注意:
- 淡漠型甲亢往往以消瘦或心房顫動為首要表現,高代謝綜合症的其它表現並不明顯。
- 僅TSH水平下降而甲狀腺激素水平正常者,應考慮亞臨床甲亢或危重患者合併甲亢[12]。
Graves病的診斷
[編輯]- 確診甲亢。
- 甲狀腺瀰漫性腫大(觸診和超聲檢查證實,少數病例無甲狀腺腫大)。
- 眼征。
- 皮膚損害。
- TRAb、TSAb、TPOAb、TgAb等陽性。
1、2是必須條件,3~5為輔助條件。
鑑別診斷
[編輯]甲狀腺毒症原因的鑑別
[編輯]主要與破壞性甲狀腺毒症(如無徵狀性甲狀腺炎、亞急性甲狀腺炎等)鑑別,主要根據病史、甲狀腺體徵和131I攝取率。
甲亢原因的鑑別
[編輯]主要與多結節性毒性甲狀腺腫、甲狀腺自主高功能腺瘤鑑別,主要藉助甲狀腺放射性核素掃描和超聲檢查。
治療
[編輯]目前暫無針對病因的特效治療。主要通過抑制甲狀腺功能,或者破壞甲狀腺組織達到減少甲狀腺激素產生的目的。
抗甲狀腺藥
[編輯]常用抗甲狀腺藥主要抑制甲狀腺過氧化物酶,從而抑制甲狀腺激素的合成和釋放。此外,還可能有免疫調節作用,可以減輕自體免疫。由於甲狀腺激素儲備豐富,因此,需要數周時間才逐漸顯示療效。抗甲狀腺藥可分為:
- 硫脲類:代表藥是丙硫氧嘧啶(propylthiouracil,PTU)。起效較快,且可抑制T4在外周轉化為T3;蛋白結合率高,不易透過胎盤和乳腺,可在妊娠和哺乳時使用。但是,半衰期短,需要頻繁給藥。
- 咪唑類:代表藥是甲巰咪唑(methimazole,MMI):半衰期長,可以每日服藥一次,而且效能比丙硫氧嘧啶高。在美國,甲巰咪唑被推薦為藥物治療的首選方案,除非患者處於甲狀腺危象或妊娠/哺乳狀態[13]。
抗甲狀腺藥是基礎的治療手段,適應證包括:
- 病情輕~中度。
- 甲狀腺輕~中度腫大。
- 手術前和131I治療前的準備。
- 20歲以下。
- 不宜手術者。
- 術後復發但又不宜131I治療者。
禁忌征:
- 中性粒細胞計數低於0.5×109。
- 轉氨酶>5×ULN。
- 既往應用任一種抗甲狀腺藥後出現嚴重不良反應。
副作用:
- 皮疹:發生率大約在4%~5%[6]。輕微的皮疹可以加用抗組織胺藥;如果皮疹仍持續存在,可以改用另一種抗甲狀腺藥,或考慮手術、131I治療;如果發生嚴重的過敏反應,不宜再換用另一種抗甲狀腺藥[13]。
- 粒細胞減少:由於Graves病本身也可能導致白細胞減少,因此,在抗甲狀腺藥治療前應該常規檢測血常規,以便隨訪時對比。如果治療前,患者的中性粒細胞計數低於0.5×109,則為抗甲狀腺藥的禁忌征。治療過程中是否需要定期複查血常規仍有爭議。在中華人民共和國的臨床實踐中,血常規是定期複查的項目之一[6]。美國的學者則認為粒細胞缺乏的發生率很低(約0.2%~0.5%),且為突然發生,因此,定期檢測血常規意義不大;再加上一旦發生粒細胞缺乏,患者常常有咽痛、發燒等表現,因此,推薦患者在出現咽痛、發燒時立即複查血常規,不推薦定期複查血常規[7][13]。
- 肝損害:丙硫氧嘧啶的肝損害發生率較甲巰咪唑高,少數患者可發展至致死性肝衰竭。常規監測肝功能是必須的,尤其是治療的頭6個月。然而,臨床醫師必須意識到,藥物誘發的肝衰竭可在毫無徵兆的情況下突然發生,因此,當患者出現噁心、嘔吐、乏力、黃疸、大便顏色變淺、皮膚瘙癢等徵狀時,應及時檢測肝功能。對於轉氨酶的輕度升高,原因可能是甲狀腺毒症,也可能是藥物,鑑別診斷需靠動態監測肝功能變化。當轉氨酶>3×ULN並持續1周以上時,應停用丙硫氧嘧啶,並且每周至少複查肝功能一次,如恢復不理想,應請肝病科/消化科醫師會診。對於丙硫氧嘧啶引起的輕度肝損害,也可以換用甲巰咪唑。
停藥指證:主要根據徵狀、體徵,一般認為抗甲狀腺藥維持治療18~24個月可以停藥。抗甲狀腺藥對病因(自體免疫)沒有根治作用,所以,停藥後復發率高,可達50%~60%[6]。鑑於此,若患者對抗甲狀腺藥耐受良好,也可以長期服藥治療[7][13];不過,服藥超過18個月,似乎已無法再降低復發率[13]。出現下列情況時預示Graves病可能治癒:
- TRAb(或TSAb)轉陰。
- 甲狀腺明顯縮小。
停藥後仍需每1~3個月複查甲狀腺功能,至少持續6~12個月,以便發現早期復發;此外,患者如果發現自己出現Graves病的表現,應及時就診[13]。
131I治療
[編輯]機制:131I釋放β粒子破壞組織。由於只有甲狀腺能夠富集131I,因此,甲狀腺外組織基本不受影響。 適應證:
- 甲狀腺腫Ⅱ度以上。
- 合併白細胞減少、血小板減少或全血細胞減少。
- 合併甲狀腺毒症性心臟病或其它心臟病。
- 合併糖尿病。
- 合併自主功能性甲狀腺結節。
- 老年。
- 抗甲狀腺藥治療禁忌或失敗。
- 術後復發。
相對適應證:
- 兒童、青少年,抗甲狀腺藥治療失敗而又因拒絕或存在禁忌無法手術的。
- 合併肝、腎等臟器功能損害的。
- Graves眶病。
禁忌證:妊娠和哺乳期。
併發症:本療法已有60餘年經驗,已證實治療劑量下的131I暴露不存在致癌風險,不影響患者生育能力,不增加遺傳缺陷發生率(前提是不在妊娠期使用,並且治療後6個月內避孕),不傷害甲狀腺外組織、器官。治療成功率高,僅少數患者要在3~6個月後接受第二次治療,個別患者需多次接受治療[6][7][12]。
- Graves眶病加重:對輕度和穩定的中、重度病例仍可安全地接受131I單獨治療。進展期患者則需在治療前後加用糖皮質激素,必要時可待Graves眶病控制後再接受131I治療。此外,吸煙可增加131I治療後Graves眶病加重的風險,並降低糖皮質激素的保護作用,因此,131I治療前最好戒煙[7]。
- 放射性甲狀腺炎:在治療後短期內出現,通常比較輕微。由於甲狀腺激素釋放增加,可能導致病情一過性加重。
- 甲狀腺功能減退症:最主要的併發症,而且幾乎無法避免。在治療後逐漸顯現,確診後需終生服用甲狀腺激素進行替代治療。由於替代劑量的甲狀腺激素幾乎沒有副作用,終生甲狀腺激素替代治療優於抗甲狀腺藥治療,因此,在美國,131I治療是最受青睞的選擇[6][12][13]。
- 甲狀旁腺功能亢進症:罹患風險終生增加,因此,需要定期監測血鈣水平[7]。
適應證:
- 中度以上甲亢。
- 腺體較大,伴有壓迫徵狀。
- 胸骨後甲狀腺腫。
- 合併多結節性甲狀腺腫。
- 抗甲狀腺藥治療後復發,或無法堅持長期服藥。
- 131I後復發。
禁忌證:
- 徵狀較輕者。
- 青少年。
- 老年人。
- 合併嚴重器質性疾病不能耐受手術者。
由於甲亢與妊娠存在不利的相互影響,妊娠早、中期並非手術的禁忌證。 併發症:術後呼吸困難和窒息、喉返神經損傷、喉上神經損傷、甲狀旁腺功能減退症、甲狀腺危象。
其它治療
[編輯]- 低碘飲食:減少甲狀腺激素合成的原料。
- 碘劑:藉助Wolff-Chaikoff效應迅速抑制甲狀腺激素的釋放,並能減輕甲狀腺腫大、充血。不過,碘劑的抗甲狀腺作用僅能維持2周左右,隨後表現為促甲狀腺作用,因此,僅限於甲狀腺危象或術前的治療,並必須配合抗甲狀腺藥。
- β阻滯藥:減輕交感興奮性,T4在外周轉化為T3。常用普萘洛爾;如果合併氣道痙攣性疾病,可以選用選擇性β1阻滯藥。
- 碳酸鋰:抑制TRAb與TSH受體結合,從而抑制甲狀腺激素的釋放。副作用較多,目前已少用。
- 碘番酸、碘泊酸鈉:可抑制T4在外周轉化為T3,用藥24小時內T3平均降幅可達62%,可用於甲狀腺危象、重症甲亢、不耐受硫脲類和新生兒甲亢。由於碘番酸、碘泊酸鈉可抑制甲狀腺對碘的攝取,如果需行131I治療,應待停藥7天後進行[7]。
- 其它:如高氯酸鉀等,現已少用。
特殊情況的處理
[編輯]- 甲狀腺風暴:應緊急處置,包括治療誘因,並予丙硫氧嘧啶(次選甲巰咪唑)、碘劑(次選碳酸鋰)、普萘洛爾、皮質醇,加強支持治療。效果不理想時可以考慮血液淨化治療。
- 妊娠前發現甲亢:在甲亢控制前,不宜妊娠。如果接受131I治療,則應在治療結束6個月後再考慮妊娠。
- 妊娠期甲亢:
- 如採用藥物治療,首選丙硫氧嘧啶,只需維持甲狀腺激素水平在正常上限即可,以避免丙硫氧嘧啶劑量過大導致胎兒甲狀腺功能減退;同時,妊娠也需要維持較高水平的甲狀腺激素。隨着妊娠的繼續,由於生理性免疫抑制作用增強,丙硫氧嘧啶往往可以減量;相反,產後隨着生理性免疫抑制的解除,Graves病容易復發,而且藥物劑量需要增加。一般不宜應用普萘洛爾。
- 如接受手術治療,通常可先予丙硫氧嘧啶,待妊娠4~6個月時手術。
- 131I治療是禁忌。
- 哺乳期甲亢:
- 藥物治療首選丙硫氧嘧啶。
- 亦可考慮手術治療。
- 131I治療是禁忌。
- 甲狀腺毒症性心臟病:
- 儘早開始足量抗甲狀腺藥。
- 甲狀腺毒症控制後,儘早開始大劑量131I治療。加強β阻滯藥治療,以防止放射性甲狀腺炎期間甲狀腺毒症一過性加重影響心臟。131I治療應不斷監測甲狀腺激素和TSH水平,根據情況調整抗甲狀腺藥或甲狀腺素的劑量,以維持甲狀腺功能在正常範圍,避免臨床或亞臨床甲亢或甲減。
- 如抗甲狀腺藥治療後病情好轉,可以耐受手術,亦可考慮手術治療。
- β阻滯藥:控制心動過速,以及心動過速誘發的心力衰竭。可合用洋地黃製劑,以對抗β阻滯藥的負性變力作用。
- 心房顫動可採用β阻滯藥和/或洋地黃控制,甲亢控制後可以實施電轉律。
- 心力衰竭的治療與普通心力衰竭相同,包括限制鈉鹽攝入、利尿等,只是治療難度更大。
參考文獻
[編輯]- ^ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 Graves' Disease. National Institute of Diabetes and Digestive and Kidney Diseases. 2012-08-10 [2015-04-02]. (原始內容存檔於2015-04-02).
- ^ 2.0 2.1 Burch, Henry B.; Cooper, David S. Management of Graves Disease: A Review. JAMA. 2015-12-15, 314 (23). ISSN 0098-7484. doi:10.1001/jama.2015.16535 (英語).
- ^ 3.0 3.1 3.2 3.3 Brent, Gregory A. Graves' Disease. New England Journal of Medicine. 2008-06-12, 358 (24). ISSN 0028-4793. doi:10.1056/NEJMcp0801880 (英語).
- ^ Menconi, Francesca; Marcocci, Claudio; Marinò, Michele. Diagnosis and classification of Graves' disease. Autoimmunity Reviews. Diagnostic criteria in Autoimmune diseases. 2014-04-01, 13 (4). ISSN 1568-9972. doi:10.1016/j.autrev.2014.01.013 (英語).
- ^ 5.0 5.1 5.2 Nikiforov, Yuri E.; Biddinger, Paul W.; Nikiforova, Lester D.R.; Biddinger, Paul W. Diagnostic pathology and molecular genetics of the thyroid 2nd. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. 2012: 69 [2017-04-09]. ISBN 9781451114553. (原始內容存檔於2022-04-11).
- ^ 6.0 6.1 6.2 6.3 6.4 6.5 6.6 6.7 陸再英; 鍾南山. 内科学. 北京: 人民衛生出版社. 2008. ISBN 978-7-117-09652-2.
- ^ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 7.7 7.8 Stephen J. McPhee; Maxine A. Papadakis. Current Medical Diagnosis & Treatment 2011. US: McGraw-Hill LANGE. 2011. ISBN 978-0-07-170055-9.
- ^ 8.0 8.1 吳在德; 吳肇漢. 外科学. 北京: 人民衛生出版社. 2008. ISBN 978-7-117-09621-8.
- ^ 李甘地; 來茂德. 病理学. 北京: 人民衛生出版社. 2001. ISBN 7-117-04073-4.
- ^ Vinay Kumar; Abul K. Abbas. Robbins and Cotran Pathologic Basis of Disease. Pennsylvania: Elsevier. 2005. ISBN 0-8089-2302-1.
- ^ 賽諾菲安萬特(sanofi aventis)公司. 可达龙 [Cordarone®]详细药物处方信息. 美迪醫訊. [2011-11-29]. (原始內容存檔於2021-09-19) (中文(中國大陸)).
- ^ 12.0 12.1 12.2 12.3 Hyperthyroidism - Endocrine and Metabolic Disorders. Merck Manuals Professional Edition. [2022-10-27]. (原始內容存檔於2023-01-28) (美國英語).
- ^ 13.0 13.1 13.2 13.3 13.4 13.5 13.6 13.7 13.8 Bahn, Rebecca S.; Burch, Henry B.; Cooper, David S.; Garber, Jeffrey R.; Greenlee, M. Carol; Klein, Irwin; Laurberg, Peter; McDougall, I. Ross; Montori, Victor M.; Rivkees, Scott A.; Ross, Douglas S. Hyperthyroidism and Other Causes of Thyrotoxicosis: Management Guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Endocrine Practice. 2011-05-01, 17 (3). ISSN 1530-891X. PMID 21700562. doi:10.4158/EP.17.3.456 (英語).
