維里展開
維里狀態方程,即維里展開,又稱昂內斯方程,最初由卡末林·昂內斯[1]提出,它廣泛用於替代大量PρT等溫線數據。如果一個維里狀態方程包含足夠的維里係數和足夠的溫度項,那麼它可以取代大量精密的PρT數據。這種維里狀態方程可以在數學上取代大量的數據表,同時不需要理解底層的熱力學。
理想氣體定律可以用壓縮係數Z(compressibility factor)表示:
T是絕對溫度,R是通用氣體常數,v是摩爾體積。對於真正的氣體和液體,Z不等於1,偏差取決於溫度,壓力和摩爾體積。其偏差可以用維里狀態方程表示:
其中ρ=1/v是流體的莫耳密度,這是表示流體PρT性質的最通用的狀態方程。A是第一維里係數,其值恆為1,表示在低莫爾密度下,所有流體接近理想氣體。維里系數B,C,D等是溫度的函數,並且通常以1/T的泰勒級數表示。壓縮系數是無單位數量,表明流體偏離理想氣體的程度。
第二和第三維里係數
[編輯]第二和第三維里係數已被廣泛研究一個多世紀,許多流體已有它們的表列。最廣泛的表列在Dymonds的書中[2][3]。最近,美國國家標準與技術研究所熱力學研究中心(Thermodynamics Research Center of National Institute of Standards and Technology, NIST / TRC)以Web Thermo Tables(WTT)的形式發佈了大量的熱力學數據)[4]。在WTT-Lite版本中,可以上線查看關於150液體經過嚴格審查的數據。許多流體的第二和第三維里係數的表也包括在這版本中。
在Dymonds的書和WTT表中,由氬代表的第二和第三維里係數如右圖所示。減縮溫度和減縮維里係數都是無單位數量。大多數流體具有相同的係數曲線。
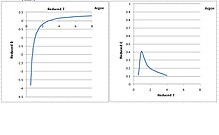
隨着溫度的降低,第二維里係數持續降低。然而,第三維里係數具有鐘形。隨着溫度降低到臨界溫度,它升高到峰值,並隨着溫度從臨界點降低到三點而迅速下降到0。由於第三維里係數理論上代表三個分子之間的排斥力,預計在較低的溫度下會隨着分子被壓在一起而增加,所以在臨界溫度以下持續降低,不合乎物理學的預期。
第三維里係數臨界溫度以下降低的原因是計算錯誤。通常PρT等溫線在氣相中可以方便地測量。在臨界溫度以下,氣相冷凝並與液相共存,PρT等溫線變平。飽和壓力不變,直到所有氣體冷凝成液體,然後壓力隨密度增加而上升。在純氣相和純液相之間存在一個很大的間隙,其中沒有可用的壓力數據(只有飽和壓力)。如果僅僅分析氣相中的數據,則第三維里係數變得非常小,因為PρT等溫線在氣相中幾乎是線性的。然而,如果包括純液相中的數據點,二階回歸法將給出相當大的第三維里係數。由此導出的第三維里係數隨着溫度降低而持續增加。
有些狀態方程能準確預測氣相和液相共存的飽和區中的PρT等溫線,我們可以用這些狀態方程來驗證第三維里係數與1/T的函數關係。大多數狀態方程可以轉化為維里方程,從而可以比較它們所產生的第二和第三維里係數。
將狀態方程改寫為維里方程
[編輯]大多數狀態方程可以改寫為維里方程,這樣就可以準確地互相評估和比較它們隱含的第二和第三維里係數。
其中v=1/ρ是摩爾體積。我們可以將1/(v-b)擴展為泰勒級數來重新排列:
第二維里係數大致正確,因為當溫度降低時它變為負值。第三和更高的維里係數與溫度無關,這是不正確的,特別是在低溫下。
所有隨後由van der Waals方程導出的狀態方程,如Dieterici[6]、Berthelot[7]、Redlich-Kwong[8] Peng-Robinson[9]等等,都受到了由1/(v-b)項的限制,在低於臨界溫度時不能準確地表示PρT等溫線。其中許多狀態方程產生正確的第二維里係數,但大多數狀態方程都產生不正確的第三維里係數。
然而,由Beattie-Bridgeman[10]啟迪的另一類狀態方程與維里方程更密切相關,並且在氣相和液相中更準確。它們可以容易地重寫成維里方程,並相互比較。 1928年提出的Beattie-Bridgeman狀態方程:
其中
可以重新排列:
該狀態方程的第二維里係數與實驗數據非常接近。然而,第三個維里係數的負號是錯誤的。因此,它不能正確表示接近臨界溫度上下的等溫線。
1940年的Benedict-Webb-Rubin狀態方程[11]就有顯着的改善,特別是在低於臨界溫度的等溫線:
Starling [12] 在1972年提出了更多的改進:
右圖是根據Starling的減縮溫度與第二和第三減縮維里係數的曲線:

最後兩個方程中的指數項是令人意外的,而且不合乎維里級數序列。然而,隨着ρ增加,這指數項收斂得非常快,如果我們在它的泰勒級數序列中僅取前兩項,並將其乘以,則結果為。因此,它對第三維里係數貢獻了項,另一項是在第八維里係數中,可以忽略。
取代了指數項後,Benedict-Webb-Rubin與Starling方程有這種有趣的形式:
第四和第五維里係數為零。在第三維里項之後,下一個重要項是第六維里項。看起來,前三個維里項主導了流體的壓縮係數,溫度範圍降至,密度範圍最高可達。
還有一點值得注意的是,在1901年的昂內斯的原始研究中,他認為第四維里係數D=0,並將更高項聚集為其維里方程中的一個殘餘值。然而,第三維里係數的物理意義從未被充分認識,並且它對氣液平衡的影響,被其他較高維里係數所掩蓋,這是"多變量優化算法"的重要缺失。
現在我們可以了解為什麼Benedict-Webb-Rubin在Beattie-Bridgeman狀態方程中增加複雜的指數項。 他們認識到氣相中的第三維里係數很小,但在液相中必須加大。他們沒有加大第三維里係數,而是添加這個奇怪的指數項,但是其唯一目的是使第三維里係數在低溫度下加大。 這個指數項的泰勒級數揭示了他們的真實意圖。
重新分析Starling的數據,維里係數最好的表示公式是:
使用簡單的二階回歸分析法來分析實驗的PρT等溫線,可以確定b和c。然後可以使用三階回歸法分析b和c來確定和。去除了維里方程的前三項後的殘餘值,可以用來分析之值。重新分析Starling報道的數據,得到的一些結果顯示在下表中。這些係數都是無單位數量,因為它們都以臨界摩爾體積和臨界溫度減縮。
| Fluid | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Methane | 0.440 | -1.171 | -0.236 | -0.210 | 0.364 | -0.275 | -0.014 | 0.396 | 0.0319 | 1.71E-03 |
| Ethane | 0.330 | -0.806 | -0.363 | -0.378 | 0.553 | -0.675 | -0.038 | 0.680 | 0.0461 | 2.63E-03 |
| Propanr | 0.288 | -0.706 | -0.245 | -0.575 | 0.532 | -0.546 | -0.308 | 0.843 | 0.0334 | 1.89E-02 |
| n-butane | 0.377 | -0.916 | -0.115 | -0.610 | 0.547 | -0.519 | -0.347 | 0.871 | 0.0305 | 2.04E-02 |
| i-butane | 0.438 | -1.051 | -0.172 | -0.401 | 0.483 | -0.342 | -0.021 | 0.538 | 0.0194 | 1.19E-03 |
| n-pentane | 0.481 | -1.056 | -0.166 | -0.560 | 0.668 | -0.720 | -0.204 | 0.841 | 0.0411 | 1.17E-02 |
| i-pentane | 0.242 | -0.674 | -0.306 | -0.520 | 0.815 | -0.943 | -0.194 | 0.868 | 0.0484 | 9.99E-03 |
| n-heane | 0.435 | -0.636 | -0.358 | -0.759 | 0.848 | -1.275 | -0.105 | 1.120 | 0.0604 | 4.98E-03 |
| n-heptane | 0.493 | -0.798 | -0.636 | -0.428 | 0.589 | -0.738 | -0.017 | 0.814 | 0.0508 | 1.21E-03 |
| n-octane | 0.600 | -0.744 | -0.456 | -0.763 | 0.174 | -0.197 | -0.272 | 0.919 | 0.0144 | 1.99E-02 |
| nitrogen | 0.502 | -1.380 | 0.092 | -0.333 | 0.400 | -0.276 | -0.027 | 0.322 | 0.0279 | 2.72E-03 |
| CO2 | 0.178 | -0.044 | -1.517 | 0.039 | 0.428 | -0.422 | -0.008 | 0.687 | 0.0490 | 9.52E-04 |
| H2S | 0.191 | -0.927 | -0.078 | -0.366 | 1.093 | -1.227 | -0.001 | 0.577 | 0.0578 | 8.37E-05 |
三次維里狀態方程
[編輯]去除了維里方程的最後的余值項,這個這是非常有趣而且相當準確的三次維里方程:
它具有凡得瓦方程式所有最好的屬性,但是沒有在v = b時的無限發散性。理論上,第二維里係數代表雙分子吸引力,第三個維里項表示緊密接觸的三個分子之間的排斥力。直觀地,我們期望B在低溫下變為負值,而C將保持正值以抵消B的影響,並且因此當ρ增加時,Z及壓力都持續增高。
如前所述,這種三次維里方程具有范德瓦爾斯方程的所有屬性,而在v = b時沒有發散性。在臨界狀態下, B和C係數可以利用臨界條件計算出來:
- and
三次維里方程可以解出:
- , and :
為0.333,可以與Van del Waals狀態方程解出的0.375相比。
在臨界點和三相點之間是流體的飽和區域。在此區域,氣相在飽和壓力和飽和溫度下與液相共存。在飽和壓力下,液相的摩爾體積為,氣相的摩爾體積為。相應的摩爾濃度為和。這些是計算第二和第三維里係數所需的數值。
一個正確的狀態方程必須產生一個等溫線,它在時的和vg處與的水平線相交。這樣才能表現在和下,氣體與液體的平衡。的PρT等溫線必須在時有三個根。此時三次維里方程可以改寫為:
它可以重新排列為:
因子實際上是根據理想氣體定律的飽和氣體體積,它可以命名為:
在飽和區域中,三次方程有三個根,可以寫為:
擴展為:
是 和 之間的中介體積,這些三次維里方程式完全相等。根據這些方程的一次方項,可以解出:
從二次方項可以解出B:
從三次方項C可以解出C:
由於許多流體都有、和的表列,所以用這些飽和數值計算B和C是很簡單的事情。這些結果與用Benedict-Webb-Rubin和Starling狀態方程計算出的結果大約是一致的。然而,B和C的準確性在很大程度上取決於的測定量,及其與之間的微小差異。和在低溫下很難準確測量,當將這些B與C值與PρT等溫線二階回歸法分析得出的值比較時,應考慮和引入的測量誤差。
氣液固體三相平衡
[編輯]三次維里狀態方程精確地表示從臨界點到三相點的大部分物質的氣液二相平衡,在三相點處固相開始出現。將此狀態方程擴展到氣液固體三相平衡是一件簡單的事情:
在此維里方程中,第一項的表示由分子的動能產生的壓力。第二項表示長程雙分子吸引力,並且第三項表示短程三分子斥力。第二項是隨着體積減小而拉低PVT等溫線,而第三項則推高等溫線。當溫度低於臨界點時,PVT等溫線因此具有S形彎曲,允許液相與氣相共存。
現在,如果我們有一項項來壓低液相中的PVT等溫線,並且用將其推高,就可以形成一個固相,因為這兩項會在液體和固體之間產生另一個S形彎曲。這樣的S形彎曲可以用洛倫茲函數加在凡得瓦方程上合成。[13]這種狀態方程很複雜,並且很難用數學處理。上面顯示的維里方程簡單明了,更易於用數學處理。
氬氣可以用來評估氣體固體三相平衡的維里方程。所有的PVT變量都除以各自的臨界值,而成為無單位的純數值。依照對應狀態原理(the principle of corresponding states),所有的結果將適用於其他流體。氬氣的相關數據總結在下表中:
| 物理性質 | 數值 | 臨界點相對值 |
|---|---|---|
| 臨界點體積(/mole) | 0.07459 | 1 |
| 臨界點溫度(K) | 150.687 | 1 |
| 臨界點壓力(MPa) | 4.863 | 1 |
| 臨界壓縮係數 | 0.291 | 0.291 |
| 三相點氣體體積(/mole) | 9.853 | 132.1 |
| 三相點液體體積(/mole) | 0.0282 | 0.378 |
| 三相點固體體積(/mole) | 0.246 | 0.330 |
| 三相點溫度(K) | 83.8058 | 0.553 |
| 三相點壓力(MPa) | 0.06889 | 0.0142 |
當P,V和T以其臨界相對值,、和取代時,維里方程變成以下形式:
其中、、、和。我們主要關注氬的三相點,其中的維里參數是B = 3.424和c = 1.152。
必須略大於固體的體積0.33,的體積必須在液體和固體之間。首先我們將設置為0.335 ,使等溫線在固體時急劇上升。然後我們必須估計指數n,使得n-2n位能曲線中的深谷必須落在固體(0.33)和液體(0.378)的體積之間。在確定了指數n之後,我們再調整的值以滿足吉布斯規則(Gibbs Rule),它要求在三相點溫度和壓力下,液相和固相的吉布斯自由能(Gibbs free energy)必須相等。
為了在氬氣中產生固相,指數值n必須非常大,大於20;否則,PVT等溫線不會在液體和固體之間彎曲成S形,最好的估計值是n = 30,,,和。等溫線如右圖所示,為了清晰起見,我們將其中三個維里係數項分別繪製:
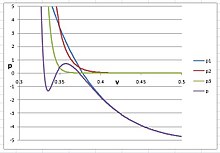
在這個圖中,表示維里方程的前三個維里項的和,它顯示了氬氣的氣液二相平衡。表示由項所貢獻的壓力,表示來自項的貢獻。當n <30時,會干擾,並顯着降低液體的體積。
令人驚訝的是n必須大於20才可能產生固相。我們知道Lenard-Jones的位能曲線用於量子力學原理以計算第二維里係數。量子力學認為第二維里係數是因雙分子吸引力產生,第三係數是因三分子排斥力產生。在氬的液相中,一個原子有12個最近的鄰原子,並且有多達32個次近鄰原子。在固相中,所有原子都被鎖定在結晶格子中,相互作用鄰原子的數量是無限的。因此,n = 30甚至更大,是完全合理的,儘管令人驚訝。
在熱力學的歷史上,我們第一次有維里狀態方程式,來準確地描述氬的氣液固三相平衡。依照對照狀態原則,在三相點所有流體都共有下列的維里方程:
維里狀態方程現況
[編輯]隨着計算機的進步,維里狀態方程被大量用來表示眾多PρT數據,而不需要深究維里係數的物理意義。從Benedict-Webb-Rubin和Starling的狀態方程來看,最好的維里狀態方程可以確定是:的形式。該方程中的第二和第三維里係數,可以使用Excel中簡單的線性回歸法從實驗PρT數據計算出來。在刪除前三個維里項之後,然後分析壓縮係數Z中的殘餘值,以獲得第六維里係數。沒有必要用複雜的「多變量優化」計算,它們的結果也不夠可信。
參考項目
[編輯]文獻資料
[編輯]- ^ Kamerlingh Onnes H., Expression of state of gases and liquids by means of series, KNAW Proceedings, 4, 1901-1902, Amsterdam, 125-147 (1902).
- ^ Dymond J. D., Wilhoit R. C., Virial coefficients of pure gases and mixtures, Springer (2003).
- ^ Dymond J. H., Smith E. B., Virial coefficients of pure gases and mixtures. A critical compilation, Oxford University Press, 1st Edition (1969), 2nd Edition (1980).
- ^ Lemmon, E.W., Huber, M.L., McLinden, M.O. NIST Standard Reference Database 23: Reference Fluid Thermodynamic and Transport Properties-REFPROP, Version 8.0, National Institute of Standards and Technology, Standard Reference Data Program: Gaithersburg, MD, (2007).
- ^ Van der Waals J. D., On the continuity of the gaseous and liquid states (Doctoral dissertation). Universiteit Leiden (1873).
- ^ Dieterici(7), C. Dieterici, Ann. Phys. Chem. Wiedemanns Ann. 69, 685 (1899).
- ^ D. Berthelot, D., in Travaux et Mémoires du Bureau international des Poids et Mesures – Tome XIII (Paris: Gauthier-Villars, 1907).
- ^ Redlich, Otto; Kwong, J. N. S. On The Thermodynamics of Solutions, Chem. Rev. 44 (1): 233–244 (1949).
- ^ Peng, D. Y.; Robinson, D. B., A New Two-Constant Equation of State. Industrial and Engineering Chemistry: Fundamentals. 15: 59–64 (1976).
- ^ Beattie, J. A., and Bridgeman, O. C., A new equation of state for fluids, Proc. Am. Acad. Art Sci., 63, 229-308 (1928).
- ^ Benedict, Manson; Webb, George B.; Rubin, Louis C., An Empirical Equation for Thermodynamic Properties of Light Hydrocarbons and Their Mixtures: I. Methane, Ethane, Propane, and n-Butane, Journal of Chemical Physics, 8 (4): 334–345 (1940).
- ^ Starling, Kenneth E., Fluid Properties for Light Petroleum Systems, Gulf Publishing Company, p. 270 (1973).
- ^ Ting C. H., Chen C., Chen S., The gas-liquid-solid equilibrium studied by a simple equation of state, J. Chung Cheng Inst. Tech., Vol 3, No. 1, 77-84 (1972).

























































































