汞
此條目可參照英語維基百科相應條目來擴充。 (2021年12月24日) |
此條目需要補充更多來源。 (2021年12月24日) |


汞(拼音:gǒng,注音:ㄍㄨㄥˇ,粵拼:hung3),俗稱水銀,是一種化學元素,其化學符號為Hg,原子序數為80,原子量為200.592 u。汞在元素週期表中位於d區,是密度大、室溫下為液態的銀白色過渡金屬,具有輕微的揮發性,且性質與惰性氣體類似。除了汞之外在常溫下呈液態的穩定元素只有溴,而銫、鎵和銣會在比室溫稍高的溫度下熔化。汞的熔點是−38.83 °C(−37.89 °F;234.32 K),沸點是356.73 °C(674.11 °F;629.88 K),是所有金屬元素中液態溫度範圍最小的。
汞在全世界的礦產中都有產出,主要來自硃砂(硫化汞)。攝入或吸入的硃砂粉塵都是微毒的。汞中毒還能由接觸可溶解於水的汞(例如氯化汞和甲基汞)引起,或是因吸入汞蒸氣,食用被汞污染的海產品或吸食入汞化合物引起中毒。
汞可用於溫度計、氣壓計、壓力計、血壓計、浮閥、水銀開關和其他裝置,但是汞的毒性導致汞溫度計和血壓計在醫療上正被逐步淘汰,取而代之的是使用酒精、鎵銦錫合金等物質填充,或者是使用基於熱電偶或壓力傳感器的數位溫度計和血壓計。汞仍被用於科學研究和補牙的汞合金材料。汞也被用於發光。螢光燈中的電流通過汞蒸氣產生波長很短的紫外線,紫外線使螢光體發出螢光,從而產生可見光。
性質
[編輯]物理性質
[編輯]汞是一種銀白色的液態重金屬。相較於其它金屬,汞導熱性能差,而導電性能較佳。[3]
汞的熔點為−38.83 °C,沸點為356.73 °C,[4][5][6]都是穩定金屬中最低的,不過對放射性元素鎶和鈇的初步實驗表明它們的沸點都比汞更低(鎶是元素週期表中汞之下的元素,遵循12族元素沸點降低的趨勢)。[7]當汞凝固時,它的體積會降低3.59%,密度從13.69 g/cm3增加到14.184 g/cm3。固體汞具有延展性,可以用刀切割。[8]
對於這個性質的完整解釋需要非常深入量子物理的領域,但是可以簡述如下:汞的核外電子組態很特別,電子填滿了所有1s、2s、2p、3s、3p、3d、4s、4p、4d、4f、5s、5p、5d和6s亞層。由於這樣的電子組態強烈地阻止汞原子失去電子,所以汞的性質與惰性氣體類似,會形成弱的分子間作用力,以至於固體非常容易熔化。
6s亞層的穩定性是源於全滿的4f亞層。f亞層會微弱地遮蔽原子核的電荷,這些電荷會增加原子核對6s亞層的庫侖引力。缺少填滿的內層f亞層是鎘和鋅沸點相對較高的原因,儘管這兩種金屬還是很容易熔化的,而且它們的沸點也非常低。[4][5]
汞曾經作為電學測量標準。像西門子電阻單位就是在1860年訂定,以汞柱電阻來計算的電阻單位[9]。1884年在巴黎的國際會議中,曾定義「法定歐姆」(legal ohm)是攝氏零度下,長度106公分,截面積為一平方公厘水銀柱的電阻[10],但現今的歐姆已不用上述的定義。
汞是人類史上首先發現到的超導體,其超導臨界溫度為絕對溫標4.2K。
商業上有關汞的交易,通常以一燒瓶的容量為單位,約重34.5公斤。
化學性質
[編輯]汞不與大多數的酸反應,例如稀鹽酸、稀硫酸、氫溴酸[11];但是氧化性酸,例如濃硫酸、濃硝酸和王水可以溶解汞並形成硫酸鹽、硝酸鹽和氯化物。汞也可和氫碘酸反應生成氫氣和H2[HgI4][11]。與銀類似,汞也可以與空氣中的硫化氫反應。汞還可以與粉末狀的硫反應,這一點被用於處理汞洩露以後吸收汞蒸氣的工具裡(也有用活性炭和鋅粉的)。[12]
汞具有恆定的體積膨脹係數,其金屬活躍性低於鋅和鎘,且不能從酸溶液中置換出氫。一般汞化合物的化合價是+1或+2,+4價的汞化合物只有四氟化汞[13][14]而+3價的汞化合物不存在[15]。
汞齊
[編輯]汞容易與大部分普通金屬形成合金,這些汞合金統稱汞齊。能與汞形成合金的金屬包括金和銀,但不包括鐵,所以鐵粉一直以來被用於置換汞。其他一些第一行的過渡金屬難於形成合金,但不包括錳、銅和鋅。其他不易與汞形成合金的元素有鉑[16][17]和其他一些金屬。鈉汞齊是有機合成中常用的還原劑,也被用於高壓鈉燈中。
當汞和純金屬鋁接觸時,它們易於形成鋁汞齊,因為鋁汞齊可以破壞防止金屬鋁的繼續氧化的氧化鋁層,所以即使很少量的汞也能嚴重腐蝕金屬鋁。出於這個原因,絕大多數情況下,汞不能被帶上飛機,因為它很容易與飛機上暴露的鋁質部件形成合金而造成危險。[18]
同位素
[編輯]汞有七種穩定的同位素,其中202Hg最豐富,占了天然汞的29.86%。汞壽命最長的放射性同位素是半衰期444年的194Hg和半衰期46.612天的203Hg,剩下的放射性同位素半衰期大多少於一天。199Hg和201Hg是最常用的核磁共振原子核,它們的自旋分別是1⁄2和3⁄2。[3]
人類對水銀的認知歷史
[編輯]在公元前1500年的古埃及墓中人們就找到了汞的存在。
在古代中國,汞被認為可以延長生命,治療骨折和保持健康,儘管人們現在已經知道汞會導致嚴重的健康損害。據史記記載,秦始皇的陵墓中以汞為水,流動在他統治的土地的模型中[19]。秦始皇死於服用鍊金術士配製的汞和玉石粉末的混合物,汞和玉粉導致了肝衰竭,汞中毒和腦損害,而它們本來是為了讓秦始皇獲得永生的。中國古代婦女還曾經採用口服少量汞的方式進行避孕。而在《證類本草》中記載,古代中國人用銀膏(汞齊)來補牙齒脫落。
古希臘人曾將汞用於油膏中,古埃及人和古羅馬人把它加入化妝品中,但有時這樣的化妝品會導致臉部變形。在瑪雅文明的大城市拉瑪奈中,人們在一個中美洲球場裡的記號下面發現了一池子的水銀。在公元前500年左右,汞已用於製造與其他金屬的合金。
18世紀和19世紀中汞用來將做氈帽的動物皮上的毛去掉,這在許多制帽工人中導致了腦損傷。在青黴素出現以前,水銀也曾一度用於治療梅毒。
鍊金術士認為汞是形成其他所有金屬的第一物質。他們認為不同的金屬可由汞中包含的不同質量和含量的硫來生成。最純的金屬是金,而人們需要汞來實現不純的金屬(基礎金屬)到金的轉變,這種轉變也是很多鍊金術士的目標,18世紀初,包括艾薩克·牛頓在內的許多著名科學家都相信水銀可以被轉化為黃金[20]。現代化學中,Hg是汞的符號,它來自人造的拉丁詞hydrargyrum,其詞根來自希臘語Ύδραργυρος(hydrargyros),這個詞的兩個詞根分別表示「水」(Hydro)和「銀」(argyros),由於汞與水一樣是液體,又像銀一樣閃亮。在西方,人們用羅馬神墨丘利來命名汞,墨丘利以他的速度和流動性著名。汞也與水星有關,天文學中水星的符號就是鍊金術士給汞的符號「☿」;而英語中水星和汞的名稱也相同。鍊金術在梵文中叫Rasavātam,意思是「汞的方式」。汞是唯一一種鍊金術士給的名字變成現在常用的名稱的金屬。
自從兩千五百年前從西班牙的阿爾馬登開始采汞礦以來,它和義大利的阿米塔山和現在的斯洛維尼亞的伊德里亞一直是主要的汞礦來源,直到19世紀末發現了新的汞礦。
1911年,荷蘭科學家海克·卡末林·昂內斯用液氦冷卻汞,當溫度下降到絕對溫標4.2K時水銀的電阻完全消失,這種現象稱為超導電性,此溫度稱為超導臨界溫度。
來源
[編輯]汞是地殼中相當稀少的一種元素,含量只有0.08ppm。因為汞的化學性質,它不易與地殼主量元素成礦,所以考慮到汞在普通岩石中的含量,汞礦中的汞是極為富集的。品位最高的汞礦有2.5%的質量是汞,即使品位最低的也有0.1%,是地殼中含量的12000倍。汞罕見於金屬單質,常見於硃砂、氯硫汞礦、硫汞銻礦和其他礦物,其中以硃砂最為常見。汞礦一般形成於非常新的造山帶,這裡高密度的岩石被推至地殼。汞礦常見於溫泉和其他火山地區。
大約世界上50%的汞來自西班牙和義大利,其他主要產地是斯洛維尼亞、俄羅斯和北美。硃砂在流動的空氣中加熱後其中的汞可以還原,溫度降低後汞凝結,這是生產汞的最主要的方式。
1554年,人們發明了用汞從銀礦中提取銀的混汞法(Patio Process)。從1558年開始,汞成為了西班牙和它的美洲殖民地的重要資源。混汞法被廣泛用於新西班牙和秘魯的銀礦。起初,西班牙王室在阿爾馬登的礦負責提供所有殖民地所需的汞。後來人們在美洲發現了汞礦。在1953年秘魯的萬卡韋利卡地區發現汞礦之後的三個世紀中,該地區開採了超過十萬噸汞。混汞法和之後發明的盤內汞化法(Pan-amalgamation)對汞有巨大需求,以便提取銀礦中的銀,這種情況一直持續到19世紀晚期。
義大利、美國和墨西哥的汞礦曾經供給了全世界大部分的汞需求,現在這些礦已被完全開採。在斯洛維尼亞和伊德里亞和西班牙的阿爾馬登,汞礦因為汞的價格下跌而被關閉。內華達的麥克德米特是美國最後一個汞礦,於1992年關閉。汞的價格波動十分劇烈,在2006年一個76磅(34.46千克)燒瓶的汞價格是650美元。
硃砂在空氣流中被加熱,發生如下反應:HgS + O2 → Hg + SO2 然後凝結蒸汽以提取汞。
2005年,中國是出產汞最多的國家,占全球市場的三分之二,吉爾吉斯斯坦次之。其他國家被認為從一些未被記錄的來源產出了汞,比如電解煉銅的過程和對廢水的提煉。
歐盟的指令要求到2012年緊湊型螢光燈變成強制性要求。這一點促使中國重新開採硃砂礦以滿足製造緊湊型螢光燈對汞的需求。於是汞對環境的影響又成為了關注的焦點,尤其是南方的佛山、廣州等城市和西南的貴州省。
廢棄的汞礦往往有成堆的有害的硃砂的煅燒灰。從這些地方流過的水是很大的生態破壞的來源。舊的汞礦可能可以重建以再利用。1976年,加州的聖塔克拉拉郡購買了歷史上的阿爾馬登汞礦,在進行了深入的安全和環保分析之後,郡政府在原來的汞礦上面建立了一座公園。
化合物
[編輯]汞有兩種主要氧化態,+1價和+2價。儘管有聲稱發現的報告,[21]汞(III)和汞(IV)化合物仍然未知,[22][23]儘管短壽命的Hg(III)化合物可以通過電化學氧化產生。[24]
汞(I)化合物
[編輯]與同組的鋅和鎘不同的是,汞一般通過金屬鍵形成簡單穩定的化合物。大多數+1價汞的化合物是反磁性的,並且形成二聚離子Hg22+。穩定化合物包括鹽酸鹽和硝酸鹽。+1價汞的錯合物可以與強絡合劑反應,例如硫離子和氰根離子等,發生歧化,生成Hg2+和單質汞。[25]氯化亞汞,又名甘汞,是一種無色固體,化學式為Hg2Cl2,原子的連接方式為Cl-Hg-Hg-Cl。它是電化學中的一種標準物質,也用於醫學中。它可與氯氣反應生成氯化汞。氫化亞汞是一種無色氣體,化學式為HgH,其中沒有汞-汞鍵。
汞易於與自身結合,形成多汞陽離子,例如Hg32+(AsF6-)2中的Hg32+。[26]
汞(II)化合物
[編輯]+2價是汞最常見的氧化態,也是自然界中非常重要的一種。汞的四種鹵化物都存在。+2價汞離子與其他配合體形成正四面體的錯合物,但是與鹵素形成線性的錯合物,與銀離子類似。最常見的是氯化汞(又稱氯化高汞,升汞,氯化汞(II)),一種易升華的白色固體,是腐蝕性極強的劇毒物品。氯化汞通常形成正四面體的錯合物,例如HgCl42-。
氧化汞是汞的主要的氧化物,由汞與高溫空氣長時間接觸後產生。氧化汞加熱至近400 °C時會分解成汞和氧氣。約瑟夫·普里斯特利早期製造純氧時曾應用這一反應。[12]與金和銀的情況類似,人們對汞的氫氧化物了解較少。
作為一種軟金屬,汞可以與較重的氧族元素形成穩定的化合物。其中非常突出的是硫化汞,HgS。硫化汞在自然界中以硃砂的形式出現,是一種非常好的朱紅色素,常用於印泥。硃砂也是一種礦石中藥材,也是道士煉丹的一種常用材料。與硫化鋅一樣,硫化汞也有兩種同質異形體,分別是紅色的立方晶體和黑色的閃鋅礦結構晶體[3],後者在天然中以metacinnabar的形式存在。[27]硒化汞(HgSe)和碲化汞(HgTe)也是已知的,它們和其他一些衍生物,例如半導體碲化汞鎘和碲化汞鋅,都是很好的紅外線探測材料。[28]
+2價汞的鹽可與氨形成一系列的衍生物,包括米隆鹼(Hg2N+),一維的高聚物 ((HgNH22+)n),易溶的白降汞([Hg(NH3)2]Cl2)。奈斯勒試劑,又稱碘化汞鉀,仍有時被用來測試氨的存在,因為氨容易於其反應形成深色的米隆鹼的碘鹽。
雷酸汞是一種廣泛應用的烈性炸藥,[3]用於早期的雷管,但目前已被更穩定的起爆藥所代替。
更高價的氧化態
[編輯]高於+2價的氧化態而非離子形態的汞極為罕見。在羥汞化反應中可能會有一種中間產物是環狀的有3個取代基的+4價汞離子。2007年,+4價汞的氟化物被合成出來。20世紀70年代曾有人聲稱合成出了+3價汞的化合物,但是現在普遍認為這是假的。
有機汞化合物
[編輯]在歷史上有機汞化合物很重要,但是在西方世界幾乎沒有工業價值。+2價的汞鹽是極少的能直接與芳香環反應的簡單的金屬錯合物。有機汞化合物總是二價的,配位數一般是2,形成直線型化合物。與有機鎘化合物和有機鋅化合物不同,有機汞化合物不與水反應。有機汞化合物一般形成通式為HgR2或HgRX的化合物,前者多易揮發而後者多為固體。其中R是芳基或烷基,X一般是鹵素或乙酸根。甲基汞表示一系列化學式為CH3HgX的化合物。甲基汞危害非常大,經常出現在被污染的河流或湖泊中。[29]甲基汞會導致生物甲基化作用。
其它
[編輯]實驗發現在電弧中惰性氣體可以與汞蒸氣發生相互作用(並未真正發生化學反應)。這些包合物(HgNe、HgAr、HgKr和HgXe)以凡得瓦力相連。
毒性
[編輯]純汞有毒,其化合物和鹽的毒性多數非常高,口服、吸入或接觸後可以導致腦和肝損傷,故今天的溫度計大多數使用酒精取代汞,但因其精確度高,一些醫用溫度計仍然使用汞。
在標準氣溫和氣壓下,純汞最大的危險是它很容易氧化而產生氧化汞,氧化汞容易形成小顆粒從而加大它的表面積。
雖然純汞比其化合物的毒性低,但它依然是一種很危險的污染物,因為它在生物體內會形成有機化合物。
最危險的汞有機化合物是二甲基汞[(CH3)2Hg],僅數微升接觸在皮膚上就可以致死。
硫化汞是毒性較低的化合物。
汞可以在生物體內積累,很容易被皮膚以及呼吸道和消化道吸收。水俁病是汞中毒的一種。汞破壞中樞神經系統,對口、黏膜和牙齒有不良影響。長時間暴露在高汞環境中可以導致腦損傷和死亡。儘管汞沸點很高,但在室內溫度下飽和的汞蒸氣已經達到了中毒劑量的數倍。
因此在操作汞時要特別小心。盛汞的容器要特別防止它溢出或蒸發,加熱汞或者受熱易分解的汞化合物時,一定要在一個通風和過濾良好的罩子下進行。此外,有些汞的化合物即使不受熱也會自動還原為純汞,而純汞則會蒸發,這往往會被忽視。
如果汞灑出來(例如一些溫度計或者螢光燈裡的汞),就需要特別的處理步驟來吸收灑出的汞和避免接觸。常用的操作包括把小的液滴聚攏在堅硬的物體表面以便合成大的液滴,這樣可以方便用滴管清除;也可以輕柔地把灑出的汞推進一次性的容器。吸塵器和掃帚不能使用,它們會造成汞的擴散。物理清除之後,可以在被汞污染的區域噴灑硫磺粉、鋅粉或其他易與汞在室溫下形成合金的粉末,然後再收集反應物並妥善處理。在清理過汞以後,再試圖清理多孔的表面和衣服裡殘存的汞的效果就很差了,所以一般這些物品灑上汞以後應該扔掉。
汞可以導致急性和慢性的中毒。
在污染嚴重的地區,汞可能會隨雨水落下。大氣中大部分的汞來自東亞。[30]
自然界中汞的排放
[編輯]工業時代以前的大氣中的汞沉降速率可能是大約4納克每升積冰。儘管這可以看做是一般的自然界的沉降速率,這個速率會受到當地或者全球的汞的來源的極大影響。火山爆發可以使大氣裡的汞增加4到6倍。大氣裡大約一半的汞來源於自然界,例如火山。人類活動產生的另一半可以細分為以下來源:
65%來自燃料的燃燒,其中燒煤的火力發電站是最大的來源(美國1999年40%的汞排放來源於此)。這包括了發電站燒的天然氣裡未被清除的汞。煤的燃燒排放的汞比油排放的高一到兩個數量級,各國具體情況不同。
11%來自金的生產。美國最大的三個點污染源是三個最大的金礦。在加拿大東部,水化學作用從金礦殘渣中釋放的汞已經是大氣中汞的重要來源。
6.8%來自非鐵金屬的生產,常見來源為熔爐。
6.4%來自水泥的生產。
3.0%來自污物和廢物的處理,包括生活垃圾和有害物的處理、火葬場以及下水道污泥的焚化。
3.0%來自氫氧化鈉的生產。
1.1%來自汞的生產,主要用於電池。
2.0%來自其他所有來源。
以上的百分比來自於2000年人類活動排放的汞,不包括生物燃料燃燒的排放,而這一項在有些地區是很重要的來源。
應用
[編輯]

汞最常用的應用是造工業用化學藥物以及在電子或電器產品中獲得應用。汞還用於溫度計,尤其是在測量高溫的溫度計。越來越多的氣態汞仍用於製造日光燈,而很多的其他應用都因影響健康和安全的問題而被逐漸淘汰,取而代之的是毒性弱但貴很多的鎵銦錫合金。除此之外汞之用途還有:
- 可將金從其礦物中分解出來,因此經常用於金礦。
- 氣壓計和擴散泵等儀器。
- 三相點是-38.8344 °C,它是一個溫度的標準點。
- 氣態汞用於汞蒸氣燈。
- 用於製造液體鏡面望遠鏡。利用旋轉使液體形成拋物面形狀,以此作為主鏡進行天文觀測的望遠鏡,價格為普通望遠鏡的三分之一。
- 1900年代至1970年代,高壓交流電轉換直流電的汞弧管(汞弧整流器)裡面含有汞。從1970年代中期起,汞弧整流器被矽半導體整流器和大功率晶閘管電路所取代。
- 歷史上曾被用於治療梅毒等性病,但由於毒副作用過大而早已被淘汰。
- 其他用途:水銀開關、殺蟲劑、生產氯和氫氧化鈉的過程中作為汞陰極、防腐劑、在一些電解設備中充當電極、電池和催化劑。
醫藥
[編輯]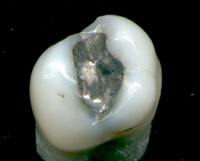
汞和它的化合物一直被用於藥物,汞齊對病患是很安全的,是一種製成牙齒填補物的重要元素。儘管現在不如以前那麼常見了,因為現在汞和它的化合物的毒性已經被更廣泛地知曉(憂心汞齊在高溫時會蒸發出汞蒸汽)。硫柳汞是一種用於疫苗中的有機物防腐劑,儘管它的使用已被禁止。另一種汞化合物,汞溴紅,是一種局部外用的消毒劑,用於微小切口和表面創傷;在某些國家它仍被使用。
化妝品
[編輯]硫柳汞(Thiomersal)廣泛用於製造染眉毛膏。在2008年,美國明尼蘇達州成為美國第一個禁止在化妝品中加入汞的州。
法規
[編輯]2013年10月10日,由聯合國環境規劃署主辦的「汞條約外交會議」在日本熊本市表決通過了旨在控制和減少全球汞排放的《關於汞的水俁公約》。該公約的名字是為了紀念在熊本市發現的水俁病。87個國家和地區的代表共同簽署了公約。[31]
台灣
[編輯]在台灣的食用油脂食品衛生管理標準中,汞的最大容許量為0.05 ppm。[32]
美國
[編輯]美國國家環境保護局負責汞污染的控制和管理。有幾個法律賦予了EPA這項權利,其中包括空氣清潔法(Clean Air Act (United States)),水體清潔法(Clean Water Act),資源保護和回收法(Resource Conservation and Recovery Act)和飲水安全法(Safe Drinking Water Act)。此外,1996年通過的含汞電池和可充電電池管理法(Mercury-Containing and Rechargeable Battery Management Act)中要求逐步淘汰汞在電池的使用,並提供了多種類型的廢舊電池的經濟有效的處理方式。[33]1995年的統計數據中,北美地區的汞排放量約占全球的11%。[34]
歐盟
[編輯]在歐盟,限制在電氣和電子設備中使用有害物質的指令(參見危害性物質限制指令)要求在某些電子電器和電子產品中禁止使用汞,而在其他產品中也有汞含量不得超過1000ppm的限制(其附表中亦針對照明光源,如螢光燈管、HID等,訂定分階段實施之更嚴格的汞含量限制)。[35] 包裝中汞的含量有一定的限制(汞,鉛,六價鉻和鎘的總和限制為100ppm),並且電池中這些物質的極限為5ppm(鈕扣型電池<2%)。[36]2007年7月起,歐盟也禁止汞在非電測量設備的使用,如溫度計和氣壓計。這項禁令只適用於新設備,醫療機構將獲得豁免,並包含了一個給氣壓計製造商的兩年寬限期。[37]
挪威
[編輯]2008年1月1日,挪威頒布對於汞在製造業上的使用和汞產品的進出口行為完全禁止的法令。[38]在2002年,某些挪威的湖泊被發現受到汞污染。[39]
2008年,挪威環境部部長Erik Solheim表示汞是其中一種最具危險性的環境毒素,而目前已有更好汞代替物,因此汞的使用將被禁止。[40]
瑞典
[編輯]丹麥
[編輯]丹麥從2008年起在牙科中禁止使用汞齊。[40]
中國大陸
[編輯]根據2017年8月15日環境保護部印發的《〈關於汞的水俁公約〉生效公告》,《汞公約》將自2017年8月16日生效。[43]
2020年10月,中國國家藥監局在其網站發布《國家藥監局綜合司關於履行關於汞的水俁公約有關事項的通知》,宣布自2026年1月1日起,中國將全面禁止生產含汞體溫計和含汞血壓計產品[44]。
香港
[編輯]2021年12月1日起,根據香港法例第640章《汞管制條例》,任何人進口或出口條例附表1第1部化學品(第1部化學品),即汞及汞混合物;或存放或使用條例附表1第2部化學品(第2部化學品),必須領有環保署發出的許可證。[45] [46]
對生物的影響
[編輯]魚和貝類通常會以甲基汞的形態在體內富集汞。甲基汞是一種毒性很強的有機汞。汞和甲基汞都是脂溶性的,所以它們主要富集於內臟,儘管所有的肌肉組織中也都含有汞。處於食物鏈頂端的魚類,例如鯊魚、海豚、旗魚、國王鯖魚、藍鰭金槍魚、長鰭金槍魚和方頭魚,體內的汞含量會高於處於食物鏈低端的魚類和貝類。當體內含有汞的魚和貝類被捕食時,汞就會在捕食者內體內累積。魚類排出甲基汞的速度低於富集的速度,所以組織中的汞含量會逐漸升高。食物鏈頂端的魚類體內汞含量可達到被食用的魚類體內汞含量的十倍。這個過程叫做生物放大作用或者生物富集作用。日本的水俁市曾經因此發生過汞中毒的事件,現在這種由汞中毒引起的嚴重神經疾病被稱作水俁病。
參考資料
[編輯]- ^ "Magnetic susceptibility of the elements and inorganic compounds" (頁面存檔備份,存於網際網路檔案館) in Lide, D. R. (編), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ Weast, Robert. CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. 1984: E110. ISBN 0-8493-0464-4.
- ^ 3.0 3.1 3.2 3.3 Hammond, C. R The Elements 網際網路檔案館的存檔,存檔日期2008-06-26. in Lide, D. R. (編), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 4.0 4.1 Senese, F. Why is mercury a liquid at STP?. General Chemistry Online at Frostburg State University. [2007-05-01]. (原始內容存檔於2007-04-04).
- ^ 5.0 5.1 Norrby, L.J. Why is mercury liquid? Or, why do relativistic effects not get into chemistry textbooks?. Journal of Chemical Education. 1991, 68 (2): 110. Bibcode:1991JChEd..68..110N. S2CID 96003717. doi:10.1021/ed068p110.
- ^ Lide, D. R. (編), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press: 4.125–4.126, 2005, ISBN 0-8493-0486-5
- ^ Dynamic Periodic Table. www.ptable.com. [2016-11-22]. (原始內容存檔於2016-11-20).
- ^ Simons, E. N. Guide to Uncommon Metals. Frederick Muller. 1968: 111.
- ^ Werner Siemens, Vorschlag eines reproducirbaren Widerstandsmaaßes, Annalen der Physik und Chemie. 1860, 186 (5): pp. 1–20, (德文)
- ^ Robert B. Northrop. Introduction to Instrumentation and Measurements, Third Edition. CRC Press. 2014-06-04: 20–. ISBN 978-1-4665-9679-5.
- ^ 11.0 11.1 宋天佑、徐家寧、程功臻、王莉. 無機化學 (第四版) (下冊) 2020年9月第三刷. 北京: 高等教育出版社. 2019: 744. ISBN 978-7-04-052146-7 (中文(中國大陸)).
- ^ 12.0 12.1 Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英語).
- ^ High Oxidation States: Mercury tetrafluoride synthesized. [2012-08-22]. (原始內容存檔於2011-07-19).
- ^ Elusive Hg (IV) species has been synthesized under cryogenic conditions. 2007-10-12 [2012-08-22]. (原始內容存檔於2012-05-08).
- ^ Riedel, Sebastian; Kaupp, Martin. The highest oxidation states of the transition metal elements. Coordination Chemistry Reviews (Elsevier BV). 2009, 253 (5-6): 606–624. ISSN 0010-8545. doi:10.1016/j.ccr.2008.07.014.
- ^ Gmelin, Leopold. Hand book of chemistry. Cavendish Society. 1852: 103 (Na), 110 (W), 122 (Zn), 128 (Fe), 247 (Au), 338 (Pt) [2012-12-30]. (原始內容存檔於2013-05-09).
- ^ Soratur. Essentials of Dental Materials. Jaypee Brothers Publishers. 2002: 14. ISBN 978-81-7179-989-3. (原始內容存檔於2016-06-03).
- ^ Vargel, C.; Jacques, M.; Schmidt, M. P. Corrosion of Aluminium. Elsevier. 2004: 158 [2021-12-24]. ISBN 9780080444956. (原始內容存檔於2021-10-09).
- ^ 司馬遷. 史记.卷6.始皇帝. [2016-11-25]. (原始內容存檔於2021-03-13) (中文).
以水銀為百川江河大海,機相灌輸,上具天文,下具地理
- ^ 約翰·艾姆斯利. 致命元素. 三聯書店. 2012-6: 1. ISBN 978-7-108-03993-4 (中文(簡體)).
- ^ Wang, Xuefang; Andrews, Lester; Riedel, Sebastian; Kaupp, Martin. Mercury Is a Transition Metal: The First Experimental Evidence for HgF4. Angew. Chem. Int. Ed. 2007, 46 (44): 8371–8375. PMID 17899620. doi:10.1002/anie.200703710.
- ^ Rooms, J. F.; Wilson, A.V.; Harvey, I.; Bridgeman, A.J.; Young, N. A. Mercury-fluorine interactions: a matrix isolation investigation of Hg...F2, HgF2 and HgF4 in argon matrices. Phys Chem Chem Phys. 2008, 10 (31): 4594–605. Bibcode:2008PCCP...10.4594R. PMID 18665309. doi:10.1039/b805608k.
- ^ Riedel, S.; Kaupp, M. The Highest Oxidation States of the Transition Metal Elements. Coordination Chemistry Reviews. 2009, 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014.
- ^ Deming, Richard L.; et al. Tripositive mercury. Low temperature electrochemical oxidation of 1,4,8,11-tetraazacyclotetradecanemercury(II) tetrafluoroborate. Journal of the American Chemical Society. 1976, 98 (14): 4132–4137 [2021-12-25]. doi:10.1021/ja00430a020. (原始內容存檔於2021-12-25).
- ^ Henderson, W. Main group chemistry. Great Britain: Royal Society of Chemistry. 2000: 162. ISBN 978-0-85404-617-1. (原始內容存檔於2016-05-13).
- ^ Brown, I. D.; Gillespie, R. J.; Morgan, K. R.; Tun, Z.; Ummat, P. K. Preparation and crystal structure of mercury hexafluoroniobate (Hg
3NbF
6) and mercury hexafluorotantalate (Hg
3TaF
6): mercury layer compounds. Inorganic Chemistry. 1984, 23 (26): 4506–4508. doi:10.1021/ic00194a020. - ^ 引用錯誤:沒有為名為
metacinnabar的參考文獻提供內容 - ^ Rogalski, A. Infrared detectors. CRC Press. 2000: 507 [2021-12-25]. ISBN 978-90-5699-203-3. (原始內容存檔於2021-12-25).
- ^ National Research Council (U.S.) – Board on Environmental Studies and Toxicology. Toxicological effects of methylmercury. National Academies Press. 2000 [2021-12-25]. ISBN 978-0-309-07140-6. (原始內容存檔於2021-12-25).
- ^ 存档副本. [2005-12-14]. (原始內容存檔於2021-02-13).
- ^ 联合国《水俣公约》在日本熊本签署. 人民網. 2013-10-10 [2013-10-11]. (原始內容存檔於2020-09-14).
- ^ 食品藥物消費者知識服務網–食品法規條文查詢. Consumer.fda.gov.tw. 2013-08-20 [2014-02-07]. (原始內容存檔於2019-05-02).
- ^ Mercury: Laws and regulations. 美國國家環境保護局. 2008-04-16 [2008-05-30]. (原始內容存檔於2008-05-13).
- ^ Reductions in Mercury Emissons. International Joint Commission on the Great Lakes. [2012-10-10]. (原始內容存檔於2008-08-28).
- ^ Directive on the Restriction of the Use of Certain Hazardous Substances in Electrical and Electronic Equipment. 2002/95/EC [2012-10-10]. (原始內容存檔於2008-12-22). Article 4 Paragraph 1. e.g. "Member States shall ensure that, from July 1, 2006, new electrical and electronic equipment put on the market does not contain lead, mercury, cadmium, hexavalent chromium, polybrominated biphenyls (PBB) or polybrominated diphenyl ethers (PBDE)."
- ^ Mercury compounds in European Union:. EIA Track. 2007 [2008-05-30]. (原始內容存檔於2008-04-28).
- ^ Jones H. EU bans mercury in barometers, thermometers. Reuters. 2007-07-10 [2008-05-30]. (原始內容存檔於2021-03-22).
- ^ Norway to ban mercury. EU Business. 2007-12-21 [2008-05-30]. (原始內容存檔於2008-01-21).
- ^ Berg, T; Fjeld, E; Steinnes, E. Atmospheric mercury in Norway: contributions from different sources. The Science of the total environment. 2006, 368 (1): 3–9. PMID 16310836. doi:10.1016/j.scitotenv.2005.09.059.
- ^ 40.0 40.1 Banning Mercury Amalgam in the United States (PDF). [2014-02-07]. (原始內容存檔 (PDF)於2013-11-01).
- ^ Sweden to ban mercury - The Local. Thelocal.se. [2014-02-07]. (原始內容存檔於2021-04-11).
- ^ Sweden may be forced to lift ban on mercury - The Local. Thelocal.se. [2014-02-07]. (原始內容存檔於2020-11-01).
- ^ 《关于汞的水俣公约》生效公告. www.mee.gov.cn. [2019-10-25]. (原始內容存檔於2020-11-01).
- ^ 2026年起全面禁止生产含汞体温计. [2020-10-20]. (原始內容存檔於2020-11-01).
- ^ 存档副本. [2023-01-09]. (原始內容存檔於2023-05-13).
- ^ 存档副本. [2023-01-09]. (原始內容存檔於2022-07-12).
延伸閱讀
[編輯][在維基數據編輯]
外部連結
[編輯]- 元素汞在洛斯阿拉莫斯國家實驗室的介紹(英文)
- EnvironmentalChemistry.com —— 汞(英文)
- 元素汞在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素汞在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 汞(英文)
- 水銀 Shui Yin (頁面存檔備份,存於網際網路檔案館) 中藥標本資料庫 (香港浸會大學中醫藥學院) (繁體中文)(英文)