輔酶Q–細胞色素c還原酶
| UCR_TM | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 鑑定 | |||||||||
| 標誌 | UCR_TM | ||||||||
| Pfam | PF02921(舊版) | ||||||||
| InterPro | IPR004192 | ||||||||
| SCOP | 1be3 / SUPFAM | ||||||||
| TCDB | 3.D.3 | ||||||||
| OPM家族 | 92 | ||||||||
| OPM蛋白 | 3cx5 | ||||||||
| 膜蛋白資料庫 | 258 | ||||||||
| |||||||||
| ubiquinol—cytochrome-c reductase | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| 識別碼 | |||||||
| EC編號 | 7.1.1.8 | ||||||
| CAS號 | 9027-03-6 | ||||||
| 資料庫 | |||||||
| IntEnz | IntEnz瀏覽 | ||||||
| BRENDA | BRENDA入口 | ||||||
| ExPASy | NiceZyme瀏覽 | ||||||
| KEGG | KEGG入口 | ||||||
| MetaCyc | 代謝路徑 | ||||||
| PRIAM | 概述 | ||||||
| PDB | RCSB PDB PDBj PDBe PDBsum | ||||||
| 基因本體 | AmiGO / EGO | ||||||
| |||||||
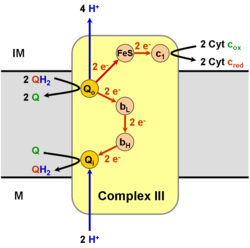
輔酶Q: 細胞色素c - 還原酶(英語:coenzyme Q : cytochrome c – oxidoreductase,),有時被稱為細胞色素bc1複合體,又有時被稱為複合體III(第三複合體,complex III),是電子傳遞鏈的第三個複合體(EC 1.10.2.2),在生化生成ATP(氧化磷酸化)中發揮關鍵作用。 複合體III是由粒線體(細胞色素b)和核心基因組(所有其他亞基)編碼的多亞基跨膜蛋白。 複合體III存在於所有動物的粒線體和所有需氧真核生物和大多數細菌的內膜中。 複合體III中的突變導致運動不耐受以及多系統疾病。 bc1複合體含有11個亞基,3個呼吸亞單位(細胞色素B,細胞色素C1,Rieske蛋白),2個核心蛋白,和6個低分子量蛋白。
- QH2 + 2 高鐵細胞色素c Q + 2 亞鐵細胞色素c + 2 H+
因此,此酶的兩個底物分別是二氫醌(QH2)與高鐵(Fe3+)細胞色素c,而其三個產物則分別是醌(Q)、亞鐵(Fe2+)細胞色素c以及H+。
該酶屬於氧化還原酶家族,特別是那些作用於細胞色素作為受體的作為供體的二酚和相關物質的氧化還原酶。 該酶參與氧化磷酸化。 它有四種輔助因子:細胞色素c1,細胞色素b-562,細胞色素b-566,和Rieske型的2-鐵鐵氧還蛋白。
命名法
[編輯]該酶類的系統名稱是泛醇:鐵細胞色素-c 氧化還原酶(英語:ubiquinol:ferricytochrome-c oxidoreductase)。 其他常用名稱包括:
|
|
結構
[編輯]
與電子傳遞鏈的其他主要質子泵亞基相比,發現的亞基數可以很小,小到三條多肽鏈。 這個數字增加了,在高等動物身上發現了11個亞基[2]。三個亞基有輔因子。 細胞色素b亞基具有兩個b型血基質(bL和bH 英語:heme),Cytochrome C亞基具有一個c型血基質(c1),並且Rieske鐵硫蛋白亞基(ISP)具有兩個鐵,兩個硫的鐵-硫簇(2Fe•2S)。
複合體的組成
[編輯]在脊椎動物中,bc1複合體,或複合體III,含有11個亞基:3個呼吸亞基,2個核心蛋白,和6個低分子量蛋白[3][4]。 變形桿菌複合體可能含有少至三個亞基[5]。
複合體III的亞基組成表
[編輯]| No. | 亞基名稱 | 人類 蛋白質 | 來自UniProt的蛋白質描述 | 帶有人類蛋白質的Pfam家族 |
|---|---|---|---|---|
| 呼吸亞基蛋白 | ||||
| 1 | MT-CYB / Cyt b | CYB_HUMAN | 細胞色素 b | Pfam PF13631 |
| 2 | CYC1 / Cyt c1 | CY1_HUMAN | 細胞色素 c1, 血基質蛋白, 粒線體的 | Pfam PF02167 |
| 3 | Rieske / UCR1 | UCRI_HUMAN | 細胞色素 b-c1 複合體 亞基 Rieske, 粒線體的 EC 1.10.2.2 | Pfam PF02921 , Pfam PF00355 |
| 核心蛋白亞基 | ||||
| 4 | QCR1 / SU1 | QCR1_HUMAN | 細胞色素 b-c1 複合體 亞基 1, 粒線體的 | Pfam PF00675, Pfam PF05193 |
| 5 | QCR2 / SU2 | QCR2_HUMAN | 細胞色素 b-c1 複合體 亞基 2, 粒線體的 | Pfam PF00675, Pfam PF05193 |
| 低分子量蛋白質亞基 | ||||
| 6 | QCR6 / SU6 | QCR6_HUMAN | Cytochrome b-c1 complex subunit 6, mitochondrial | Pfam PF02320 |
| 7 | QCR7 / SU7 | QCR7_HUMAN | Cytochrome b-c1 complex subunit 7 | Pfam PF02271 |
| 8 | QCR8 / SU8 | QCR8_HUMAN | Cytochrome b-c1 complex subunit 8 | Pfam PF02939 |
| 9 | QCR9 / SU9 / UCRC | QCR9_HUMANa | Cytochrome b-c1 complex subunit 9 | Pfam PF09165 |
| 10 | QCR10 / SU10 | QCR10_HUMAN | Cytochrome b-c1 complex subunit 10 | Pfam PF05365 |
| 11 | QCR11 / SU11 | QCR11_HUMAN | Cytochrome b-c1 complex subunit 11 | Pfam PF08997 |
- a 在脊椎動物中,來自Rieske蛋白的N-末端的8kDa的切割產物(信號肽)作為亞基9保留在複合體中。因此,亞基10和11對應於真菌QCR9p和QCR10p。
反應
[編輯]它通過輔酶Q(CoQ),又稱泛醌(Ubiquinone,UQ),的氧化催化細胞色素c的還原,同時從粒線體基質向膜間隙泵送4個質子:
- QH2 + 2 細胞色素 c (FeIII) + 2 H+
in → Q + 2 細胞色素 c (FeII) + 4 H+
out
在稱為Q循環的過程中[6][7],從基質(M)消耗了2個質子,4個質子被釋放到膜間空間(IM)中,2個電子被傳遞到細胞色素c。
反應機制
[編輯]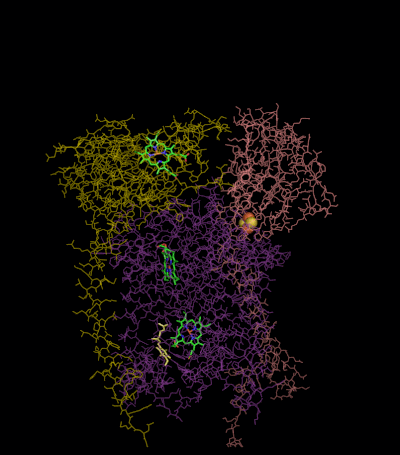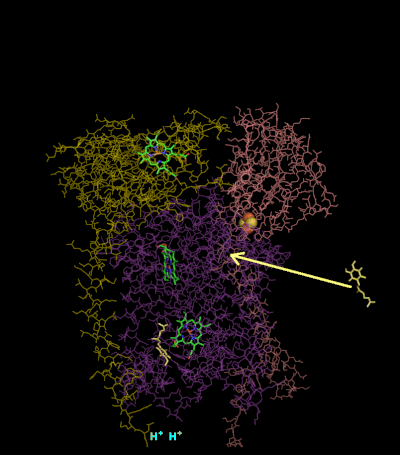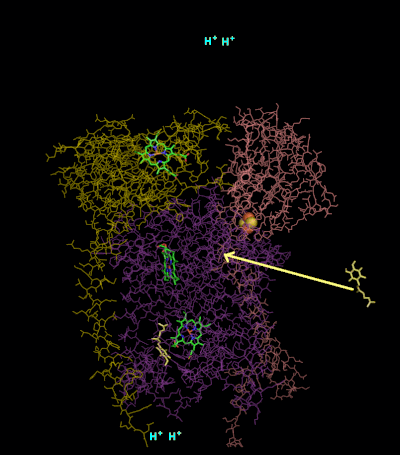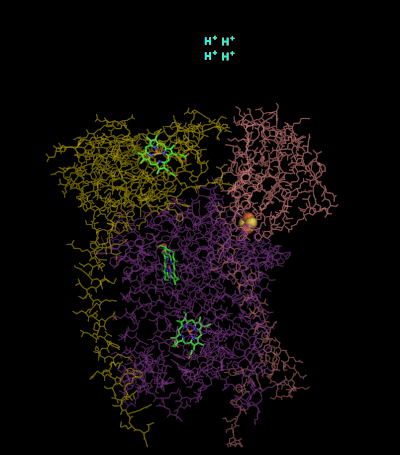
複合體III(細胞色素bc1,輔酶Q:細胞色素C氧化還原酶)的反應機制稱為輔酶(「Q」)循環。 在這個循環中,四個質子被釋放到正「P」側(膜間空間),但只有兩個質子從負「N」側(基質)被吸收。 結果,在膜上形成質子梯度。 在整個反應中,兩個泛醇被氧化成輔酶,一個輔酶被還原成泛醇。 在完整的機制中,兩個電子通過兩個細胞色素c中間體從泛醇轉移到輔酶。
總體:
- 2 x QH2氧化成Q.
- 1 x Q還原到QH2
- 2 x Cyt c被還原
- 4 x H+ 被釋放到膜間隙
- 從基質中拾取2 x H+
第1輪:
- 細胞色素b結合一個泛醇和一個泛醌。
- 2Fe / 2S中心和BL血紅素各自從結合的泛醌中吸出電子,釋放出兩個氫進入膜間隙。
- 一個電子從2Fe / 2S中心轉移到細胞色素c1,而另一個電子從BL血紅素轉移到BH血紅素。
- 細胞色素c1將其電子轉移到細胞色素c(不要與細胞色素c1混淆),BHHeme將其電子轉移到附近的泛醌,導致形成ubisemiquinone。
- 細胞色素c擴散。第一個泛醇(現在被氧化成泛醌)被釋放,而半醌仍然被束縛。
第2輪:
- 第二種泛醇與細胞色素b結合。
- 2Fe / 2S中心和BL血紅素各自從結合的泛醌中吸出電子,釋放出兩個氫進入膜間隙。
- 一個電子從2Fe / 2S中心轉移到細胞色素c1,而另一個電子從BL血紅素轉移到BH血紅素。
- 細胞色素c1然後將其電子轉移到細胞色素c,而附近的第1輪產生的半醌從BH血紅素中獲取第二個電子,以及來自基質的兩個質子。
- 釋放出第二種泛醇(現在被氧化成泛醌)以及新形成的泛醇[8]。
複合體III的抑制劑
[編輯]有三組不同的複合體III抑制劑。
- 抗黴素A與Qi位點結合併抑制複合物III中的電子從血基質bH轉移至氧化的Q(Qi位點抑制劑)。
- Myxothiazol和stigmatellin與Qo位點結合併抑制電子從還原的QH2轉移到Rieske鐵硫蛋白。 Myxothiazol和stigmatellin與Qo位點內不同但重疊的口袋結合。
- Myxothiazol更接近細胞色素bL(因此被稱為「近端」抑制劑)。
- Stigmatellin遠離血基質bL並且更接近Rieske鐵硫蛋白,與之強烈相互作用。
一些已被商業化為殺真菌劑(甲氧基丙烯酸酯Strobilurin衍生物,其中最著名的是嘧菌酯Azoxystrobin; QoI抑制劑)和抗瘧疾劑(atovaquone)。
參閱
[編輯]參考文獻
[編輯]- ^ PDB 1ntz; Gao X, Wen X, Esser L, Quinn B, Yu L, Yu CA, Xia D. Structural basis for the quinone reduction in the bc1 complex: a comparative analysis of crystal structures of mitochondrial cytochrome bc1 with bound substrate and inhibitors at the Qi site. Biochemistry. August 2003, 42 (30): 9067–80. PMID 12885240. doi:10.1021/bi0341814.
- ^ Iwata S, Lee JW, Okada K, Lee JK, Iwata M, Rasmussen B, Link TA, Ramaswamy S, Jap BK. Complete structure of the 11-subunit bovine mitochondrial cytochrome bc1 complex. Science. July 1998, 281 (5373): 64–71. PMID 9651245. doi:10.1126/science.281.5373.64.
- ^ Zhang Z, Huang L, Shulmeister VM, Chi YI, Kim KK, Hung LW, et al. Electron transfer by domain movement in cytochrome bc1.. Nature. 1998, 392 (6677): 677–84. PMID 9565029. doi:10.1038/33612.
- ^ Hao GF, Wang F, Li H, Zhu XL, Yang WC, Huang LS, et al. Computational discovery of picomolar Q(o) site inhibitors of cytochrome bc1 complex.. J Am Chem Soc. 2012, 134 (27): 11168–76. PMID 22690928. doi:10.1021/ja3001908.
- ^ Yang XH, Trumpower BL. Purification of a three-subunit ubiquinol-cytochrome c oxidoreductase complex from Paracoccus denitrificans. J Biol Chem. 1986, 261 (26): 12282–9. PMID 3017970.
- ^ Kramer DM, Roberts AG, Muller F, Cape J, Bowman MK. Q-cycle bypass reactions at the Qo site of the cytochrome bc1 (and related) complexes. Methods in Enzymology 382. 2004: 21–45. ISBN 978-0-12-182786-1. PMID 15047094. doi:10.1016/S0076-6879(04)82002-0.
|journal=被忽略 (幫助) - ^ Crofts AR. The cytochrome bc1 complex: function in the context of structure. Annu. Rev. Physiol. 2004, 66: 689–733. PMID 14977419. doi:10.1146/annurev.physiol.66.032102.150251.
- ^ Ferguson SJ, Nicholls D, Ferguson S. Bioenergetics 3rd. San Diego: Academic. 2002: 114–117. ISBN 978-0-12-518121-1.
- ^ Holmes, J. H.; Sapeika, N; Zwarenstein, H. Inhibitory effect of anti-obesity drugs on NADH dehydrogenase of mouse heart homogenates. Research Communications in Chemical Pathology and Pharmacology. 1975, 11 (4): 645–6. PMID 241101.
深入閱讀
[編輯]- Marres CM, Slater EC. Polypeptide composition of purified QH2:cytochrome c oxidoreductase from beef-heart mitochondria. Biochim. Biophys. Acta. 1977, 462 (3): 531–548. PMID 597492. doi:10.1016/0005-2728(77)90099-8.
- Rieske JS. Composition, structure, and function of complex III of the respiratory chain. Biochim. Biophys. Acta. 1976, 456 (2): 195–247. PMID 788795.
- Wikstrom M, Krab K, Saraste M. Proton-translocating cytochrome complexes. Annu. Rev. Biochem. 1981, 50: 623–655. PMID 6267990. doi:10.1146/annurev.bi.50.070181.003203.
外部連結
[編輯]- cytochrome bc1 complex site (Edward A. Berry) at lbl.gov
- cytochrome bc1 complex site (Antony R. Crofts) (頁面存檔備份,存於網際網路檔案館) at uiuc.edu
- PROMISE Database: cytochrome bc1 complex at scripps.edu
- Interactive Molecular Model of Complex III (Requires MDL Chime)
- Template:UMichOPM - Calculated positions of bc1 and related complexes in membranes
- 醫學主題詞表(MeSH):Coenzyme+Q-Cytochrome-c+Reductase

