週期性趨勢
在化學中,周期性趨勢是指元素周期表排布上存在的特定模式,用於顯現某些元素按周期或族分組時的差異性。這種模式是由俄國化學家德米特里·門捷列夫於1863年發現的。主要的周期性趨勢包括原子半徑、電離能、電子親和力、電負性、價數和金屬性。這些趨勢的存在是因為元素在各自的族或周期內具有相似的電子排布,反映了元素的周期性。此外周期性趨勢對每種元素的性質給予了定性評估[1][2]。
趨勢規律
[編輯]| 周期性質 | 周期趨勢 | 族趨勢 |
|---|---|---|
| 原子半徑 | 減少 | 增加 |
| 金屬性 | ||
| 核電荷 | 增加 | |
| 電離能 | 減少 | |
| 電子親和能 | ||
| 電負性 | ||
| 非金屬性 | ||
| 化合價 | 不變 |
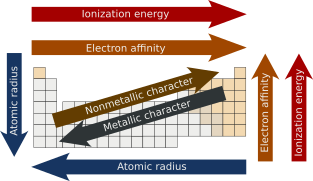
原子半徑
[編輯]原子半徑是原子核到原子最外層電子軌道的距離。一般來說,原子半徑在一個周期中由左至右逐漸減小,在一個族內從上到下依次增大。這是因為一個周期里元素的價電子均位於相同殼層,原子序數在相同的周期內從左向右逐次變大,增加了有效核電荷,吸引力的增加減小了元素的原子半徑。依各族從上至下觀察時,由於增加了新的殼層,原子半徑會增加[3][4]。
電離能
[編輯]電離能是氣態原子或離子中的電子擺脫原子核吸引力影響所必須吸收的最小能量,也被稱為電離電位。第一電離能是指從中性原子中去除第一個電子所需的能量,而從該原子中去除第二個電子所需的能量被稱為第二電離能,依此類推[5]。
在現代元素周期表的一個周期中,從左向右觀察,電離能隨著核電荷的增加和原子半徑的減小而增加,這是由於原子尺寸的減小導致電子和原子核之間的相互作用力更強。若以一組為單位從上向下觀察,由於增加了價電子層,原子半徑增加,電離能隨之降低,從而減少了原子核對電子的吸引力[6][7]。
電子親和能
[編輯]電子被添加到中性氣體原子形成陰離子時釋放的能量稱為電子親和能[8]。沿一個周期從左至右觀察趨勢,電子親和能隨著核電荷的增加和原子尺寸的減小而增加,導致原子核和新加入電子之間的吸引力更強。根據族尋找規律時,由於增加了價殼層,電子親和能會隨著原子尺寸的增加而降低,從而削弱原子核對電子的吸引力。儘管理論上氟應該具有最大的電子親和能,但其過小的尺寸使電子間產生了足夠的排斥力,導致氯在鹵族元素中具有最高的電子親和能[9]。
電負性
[編輯]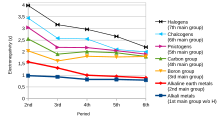
分子中原子吸引共價鍵電子的趨勢稱為電負性,這是一種無量綱屬性,因為其僅作為一種趨勢存在[10]。 最常用以測量電負性的標度是由美國化學家萊納斯·鮑林發明的鮑林標度。根據該量表,氟的電負性最強,而銫則為電負性最弱的元素[11]。
沿周期從左向右觀察,電負性會隨著核電荷增加和原子尺寸的減小而增加,而沿某一族向下移動時,因為增加了價殼層,原子尺寸增加,電負性相應降低,從而減少原子對電子的吸引力[12]。
然而在第十三族(硼族)元素中,電負性首先從硼到鋁逐漸減小,然後沿該族向下增加。這是因為更下層元素的原子直徑會增加,但同時由於內層d和f軌道電子的屏蔽效應較差,有效核電荷也會增加。結果就是原子核對電子的吸引力增大,因此從鋁到鉈電負性增大[13][14]。
化合價
[編輯]一個元素的價數是指為了獲得穩定的電子結構,原子必須失去或獲得的電子數。簡單來說,它是對元素形成化合物結合能力的一種量度。最外層的電子通常稱為價電子,價電子的數量決定了原子的價數[15][16]。
從趨勢上而言,順著一個周期從左向右觀察,元素的價電子數量從1到8逐漸增加。但是元素的價數先從1增長到4,然後在到達稀有元素一族時降低至0。沿一個族向下移動時,價電子的數量通常不會改變。因此在多數情況下,特定組的元素具有相同的價數。然而,對於較重的元素,特別是f區元素和過渡金屬,並不總是遵循這種周期性規律。這些元素表現出可變的價態,因為具有d軌道作為倒數第二和s軌道作為最外層軌道,其(n-1)d和ns軌道(例如4d和5s)的能量比較接近[17][18]。
金屬性與非金屬性
[編輯]一般來說,金屬元素在本族中的位置愈靠下,其金屬性愈強,因為原子核和最外層電子間吸引力的減小削弱了前者對電子的束縛,從而能夠傳導熱和電。在每個周期中,從左到右原子核和最外層電子間的吸引力因為核電荷的增加不斷增強,導致金屬性下降。反之,非金屬性在各族中隨所處位置的降低而降低,在各周期中依序逐次增加[19][20]。
參見
[編輯]參考資料
[編輯]- ^ The Periodic Table I. Structure and Bonding 181. 2019 [2024-09-22]. ISBN 978-3-030-40024-8. doi:10.1007/978-3-030-40025-5. (原始內容存檔於2023-12-04) (英語).
- ^ Schrobilgen, Gary J., Mingos, D. Michael P. , 編, Chemistry at the Edge of the Periodic Table: The Importance of Periodic Trends on the Discovery of the Noble Gases and the Development of Noble-Gas Chemistry, The Periodic Table I: Historical Development and Essential Features, Structure and Bonding (Cham: Springer International Publishing), 2019: 157–196 [2022-07-02], ISBN 978-3-030-40025-5, doi:10.1007/430_2019_49 (英語)
- ^ atomic and ionic radius. www.chemguide.co.uk. [2022-06-30]. (原始內容存檔於2020-11-14).
- ^ Huggins, Maurice L. Atomic Radii. I. Physical Review. 1922-04-01, 19 (4): 346–353. doi:10.1103/PhysRev.19.346.
- ^ 7.4: Ionization Energy. Chemistry LibreTexts. 2014-11-18 [2022-07-02]. (原始內容存檔於2024-07-25) (英語).
- ^ Ionization Energy Trend | Science Trends. sciencetrends.com. 2018-05-18 [2022-07-02] (美國英語).
- ^ Zadeh, Dariush H. Atomic shells according to ionization energies. Journal of Molecular Modeling. 2019-07-26, 25 (8): 251. ISSN 0948-5023. PMID 31346734. S2CID 198913558. doi:10.1007/s00894-019-4112-6 (英語).
- ^ Gooch, Jan W. (編), Electron affinity, Encyclopedic Dictionary of Polymers (New York, NY: Springer), 2007: 350 [2022-07-02], ISBN 978-0-387-30160-0, doi:10.1007/978-0-387-30160-0_4245 (英語)
- ^ Electron Affinity Trend | Science Trends. sciencetrends.com. 2018-05-14 [2022-07-02] (美國英語).
- ^ Chemistry (IUPAC), The International Union of Pure and Applied. IUPAC - electronegativity (E01990). goldbook.iupac.org. [2022-06-30]. doi:10.1351/goldbook.e01990
 . (原始內容存檔於2023-07-09).
. (原始內容存檔於2023-07-09).
- ^ Bickmore, Barry R.; Wander, Matthew C. F., White, William M. , 編, Electronegativity, Cham: Springer International Publishing: 442–444, 2018 [2022-06-30], ISBN 978-3-319-39312-4, doi:10.1007/978-3-319-39312-4_222 (英語)
- ^ Mullay, John, Sen, Kali Das; Jørgensen, C. K. , 編, Estimation of atomic and group electronegativities, Electronegativity, Structure and Bonding (Berlin/Heidelberg: Springer-Verlag), 1987, 66: 1–25 [2022-06-30], ISBN 978-3-540-17740-1, doi:10.1007/bfb0029834 (英語)
- ^ 21.1: The Elements of Group 13. Libretexts. 2013-11-26 [2022-06-30]. (原始內容存檔於2024-06-16) (英語).
- ^ Franz, Daniel; Inoue, Shigeyoshi. Advances in the development of complexes that contain a group 13 element chalcogen multiple bond. Dalton Transactions. 2016, 45 (23): 9385–9397. ISSN 1477-9226. PMID 27216700. doi:10.1039/C6DT01413E
 (英語).
(英語).
- ^ Manutchehr-Danai, Mohsen (編), valency, Dictionary of Gems and Gemology (Berlin, Heidelberg: Springer), 2009: 899 [2022-07-02], ISBN 978-3-540-72816-0, doi:10.1007/978-3-540-72816-0_22746 (英語)
- ^ Vohr, Hans-Werner (編), Valency, Berlin, Heidelberg: Springer: 947, 2016 [2022-07-02], ISBN 978-3-642-54596-2, doi:10.1007/978-3-642-54596-2_201542 (英語)
- ^ Valency. Heidelberg Science Library. 1978 [2024-09-22]. ISBN 978-0-387-90268-5. doi:10.1007/978-1-4612-6262-6. (原始內容存檔於2023-02-20) (英語).
- ^ O』Dwyer, M. F.; Kent, J. E.; Brown, R. D., O』Dwyer, M. F.; Kent, J. E.; Brown, R. D. , 編, Many-electron Atoms, Valency (New York, NY: Springer), 1978: 59–86 [2022-07-02], ISBN 978-1-4612-6262-6, doi:10.1007/978-1-4612-6262-6_4 (英語)
- ^ Daw, Murray S.; Foiles, Stephen M.; Baskes, Michael I. The embedded-atom method: a review of theory and applications. Materials Science Reports. 1993-03-01, 9 (7): 251–310. ISSN 0920-2307. doi:10.1016/0920-2307(93)90001-U
 (英語).
(英語).
- ^ C9.1 – Periodic Trends. IGCSE AID. 2018-03-05 [2022-07-02]. (原始內容存檔於2023-12-04) (英語).
