普林斯反应
普林斯反应(Prins reaction)是一種將醛或酮与烯烃或炔烃在酸催化下進行的缩合反应[1][2][3]。
此反应可用于制取二噁烷(与过量甲醛、低温)、1,3-二醇(与甲醛、水和质子酸)、烯丙醇(无水情况下失水)、氯代醇(与氯离子)和酯(与乙酸)等化合物。其中关键性的中间体是质子化的羰基化合物对烯烃的亲电加成所生成的碳正离子中间体。

历史
[编辑]1919年,荷兰化学家 Hendrik Jacobus Prins 發表了以苯乙烯(下图)、蒎烯、莰烯、丁香酚、异黄樟素和茴香脑为原料的 Prins 反应。

1937年,有人研究了利用甲醛与异丁烯的 Prins 反应并失水以制取异戊二烯(作为合成橡胶原料)的反应。

反应机理
[编辑]质子化的羰基化合物——氧鎓离子作为亲电试剂与烯烃发生亲电加成,生成关键性的碳正离子中间体 (4),它受到分子内羟基氧的邻基参与作用而得到稳定。

该碳正离子接下来有多种转化方式,而这也是反应产物多样性的来源。
- 蓝色:碳正离子被水或其他亲核试剂捕获,最终生成1,3-加成物(6)。
- 黑色:碳正离子的邻位碳质子被夺取,从而发生消除,生成不饱和化合物(7)。当原料烯烃有未取代烯碳时,其与羰基化合物的加成以及其后的消除步骤可以协同进行,烯丙位的氢经羰基-ene反应而转变为产物中的羟基氢。
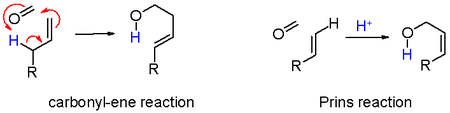
- 绿色:碳正离子被另一分子羰基化合物所捕获,经正离子中间体(8)(其中正电荷分散在氧和碳原子上),再关环,去质子化,得到最终产物二氧六环(10)。此路线的一个例子是从苯乙烯合成4-苯基-1,3-二氧六环。[4]
- 灰色:特定条件下,非常稳定的碳正离子中间体可以发生分子内环化产生噁丁环衍生物(12),类似于Paterno-Büchi 光化学反应。
变体
[编辑]1、卤代 Prins 反应:用路易斯酸(如四氯化锡或三溴化硼)代替质子酸和水,以卤离子作为亲核试剂捕获反应中的碳正离子中间体,得到卤代醇。
例如,某些烯丙基胡薄荷酮在路易斯酸催化下在二氯甲烷中发生环化,可用于构建十氢萘环系。以四氯化钛催化在−78°C环化,可生成三氯化钛-烷氧负离子中间体并发生氯离子与碳正离子的同面捕获,从而以高非对映选择性(91% cis)得到顺式产物。相反,以四氯化锡催化于室温下环化,则主要(98% trans)生成反式产物。[5]

2、串联 Prins-嚬哪醇重排:二甲缩醛(掩蔽的羰基化合物)与三异丙基硅基醚(掩蔽的醇)在四氯化锡催化之下产生的 Prins 产物再发生 pinacol 重排,用于构建五元环化合物(以及螺环化合物)。[6]

应用
[编辑]1、用于 Exiguolide 的全合成:[7]

参考资料
[编辑]- ^ Condensation of formaldehyde with some unsaturated compounds H. J. Prins, Chemisch Weekblad, 16, 64, 1072, 1510 1919
- ^ Chemical Abstracts 13, 3155 1919
- ^ The Olefin-Aldehyde Condensation. The Prins Reaction. E. Arundale, L. A. Mikeska Chem. Rev.; 1952; 51(3); 505-555. Link (页面存档备份,存于互联网档案馆)
- ^ 4-Phenyl-m-dioxane R. L. Shriner and Philip R. Ruby Organic Syntheses, Coll. Vol. 4, p.786 (1963); Vol. 33, p.72 (1953). Article (页面存档备份,存于互联网档案馆)
- ^ R. Brandon Miles, Chad E. Davis, and Robert M. Coates. Syn- and Anti-Selective Prins Cyclizations of ,-Unsaturated Ketones to 1,3-Halohydrins with Lewis Acids. J. Org. Chem. 2006, 71 (4): 1493–1501. doi:10.1021/jo052142n.
- ^ Larry E. Overman and Emile J. Velthuisen. Scope and Facial Selectivity of the Prins-Pinacol Synthesis of Attached Rings. J. Org. Chem. 2006, 71 (4): 1581–1587. doi:10.1021/jo0522862.
- ^ Min Sang Kwon, Sang Kook Woo, Seong Wook Na, and Eun Lee. Total Synthesis of (+)-Exiguolide. Angew. Chem. Int. Ed. 2008, 47: 1733–1735. doi:10.1002/anie.200705018.
外部链接
[编辑]- Prins reaction in Alkaloid total synthesis Link[失效連結]
- Prins reaction @ organic-chemistry.org (页面存档备份,存于互联网档案馆)
