三氟化钴
外观
| 三氟化钴 | |
|---|---|
| |

| |
| IUPAC名 Cobalt(III) fluoride 氟化钴(III) | |
| 别名 | 氟化钴 |
| 识别 | |
| CAS号 | 10026-18-3 |
| PubChem | 66208 |
| ChemSpider | 59593 |
| SMILES |
|
| InChI |
|
| InChIKey | WZJQNLGQTOCWDS-DFZHHIFOAL |
| EINECS | 233-062-4 |
| 性质 | |
| 化学式 | CoF3 |
| 摩尔质量 | 115.93 g·mol⁻¹ |
| 外观 | 浅棕色潮解固体 |
| 密度 | 3.88 g/cm3 |
| 熔点 | 926 °C |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
三氟化钴(化学式:CoF3),IUPAC名称氟化钴(III),室温下为不稳定的浅棕色易潮解固体,是很常用的氟化剂,用于有机氟化合物(尤其是全氟化合物)的制取,[1] 还原产物是氟化钴。类似可以用作氟化试剂的金属氟化物还有三氟化锰、二氟化银等。
与氟同族的氯也可生成钴(III)的二元化合物[2],但很不稳定,三氧化二钴溶于盐酸时便会有氯气放出。溴化钴(III)及碘化钴(III)从未制得。
制取
[编辑]氯化钴(II)或氟化钴(II)与氟气在250°C时发生快速放热反应生成三氟化钴固体:[3]
- CoCl2 + 3/2 F2 → CoF3 + Cl2
此外,用三氟化氯来氟化金属钴或一氧化钴与氟气反应也可得到三氟化钴。它为六方晶系,与氟化铁和氟化铝同晶,是一个高自旋配合物。具潮解性,可被转化为[CoF6]3−离子,是少见的高自旋八面体钴(III)配合物之一。
反应
[编辑]三氟化钴可以与许多金属或非金属单质反应生成相应的氟化物,自身被还原为二氟化钴。三氟化钴在600~700 °C分解产生二氟化钴并放出氟气,三氟化钴在此温度下于氟气中可升华。三氟化钴也有水合物,CoF3·3.5H2O,但结构尚不清楚。
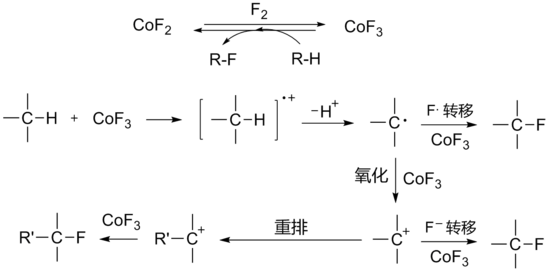
用三氟化钴氟化有机化合物时,首先用二氟化钴与氟气在300°C左右反应生成三氟化钴,然后引入有机反应物与三氟化钴反应。三氟化钴被还原后生成的二氟化钴可以循环使用。氟化反应包含单电子转移及碳正离子中间体机理:
该反应通常用于全氟有机物的制取。三氟化钴的氧化性较强,一般反应都在气相、无溶剂或以无水氟化氢作介质中进行,常伴有重排或其他副反应的发生,[1] 用相关的KCoF4氟化可使反应的选择性增强[4]。400°C左右时所有碳氢化合物的C-H键都可被转化为C-F键,并且氟也可以加到不饱和键上。
- 2CoF3 + R-H → CoF2 + R-F + HF
参考资料
[编辑]- ^ 1.0 1.1 Coe, P. L. "Cobalt(III) Fluoride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ^ Arthur W. Chester, El-Ahmadi Heiba, Ralph M. Dessau, and William J. Koehl Jr. (1969): "The interaction of cobalt(III) with chloride ion in acetic acid". Inorganic and Nuclear Chemistry Letters, volume 5, issue 4, pages 277-283. doi:10.1016/0020-1650(69)80198-4
- ^ Priest, H. F. “Anhydrous Metal Fluorides” Inorganic Syntheses McGraw-Hill: New York, 1950; Vol. 3, pages 171-183.
- ^ Coe, P. L. "Potassium Tetrafluorocobaltate(III)" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.