三氟化鈷
外觀
| 三氟化鈷 | |
|---|---|
| |

| |
| IUPAC名 Cobalt(III) fluoride 氟化鈷(III) | |
| 別名 | 氟化鈷 |
| 識別 | |
| CAS號 | 10026-18-3 |
| PubChem | 66208 |
| ChemSpider | 59593 |
| SMILES |
|
| InChI |
|
| InChIKey | WZJQNLGQTOCWDS-DFZHHIFOAL |
| EINECS | 233-062-4 |
| 性質 | |
| 化學式 | CoF3 |
| 摩爾質量 | 115.93 g·mol⁻¹ |
| 外觀 | 淺棕色潮解固體 |
| 密度 | 3.88 g/cm3 |
| 熔點 | 926 °C |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
三氟化鈷(化學式:CoF3),IUPAC名稱氟化鈷(III),室溫下為不穩定的淺棕色易潮解固體,是很常用的氟化劑,用於有機氟化合物(尤其是全氟化合物)的製取,[1] 還原產物是氟化鈷。類似可以用作氟化試劑的金屬氟化物還有三氟化錳、二氟化銀等。
與氟同族的氯也可生成鈷(III)的二元化合物[2],但很不穩定,三氧化二鈷溶於鹽酸時便會有氯氣放出。溴化鈷(III)及碘化鈷(III)從未製得。
製取
[編輯]氯化鈷(II)或氟化鈷(II)與氟氣在250°C時發生快速放熱反應生成三氟化鈷固體:[3]
- CoCl2 + 3/2 F2 → CoF3 + Cl2
此外,用三氟化氯來氟化金屬鈷或一氧化鈷與氟氣反應也可得到三氟化鈷。它為六方晶系,與氟化鐵和氟化鋁同晶,是一個高自旋配合物。具潮解性,可被轉化為[CoF6]3−離子,是少見的高自旋八面體鈷(III)配合物之一。
反應
[編輯]三氟化鈷可以與許多金屬或非金屬單質反應生成相應的氟化物,自身被還原為二氟化鈷。三氟化鈷在600~700 °C分解產生二氟化鈷並放出氟氣,三氟化鈷在此溫度下於氟氣中可升華。三氟化鈷也有水合物,CoF3·3.5H2O,但結構尚不清楚。
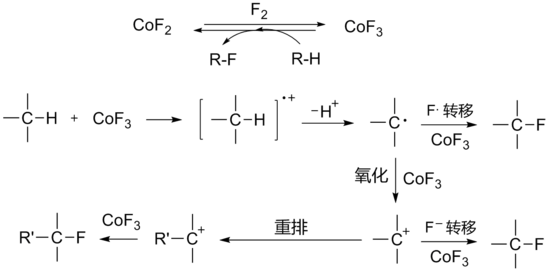
用三氟化鈷氟化有機化合物時,首先用二氟化鈷與氟氣在300°C左右反應生成三氟化鈷,然後引入有機反應物與三氟化鈷反應。三氟化鈷被還原後生成的二氟化鈷可以循環使用。氟化反應包含單電子轉移及碳正離子中間體機理:
該反應通常用於全氟有機物的製取。三氟化鈷的氧化性較強,一般反應都在氣相、無溶劑或以無水氟化氫作介質中進行,常伴有重排或其他副反應的發生,[1] 用相關的KCoF4氟化可使反應的選擇性增強[4]。400°C左右時所有碳氫化合物的C-H鍵都可被轉化為C-F鍵,並且氟也可以加到不飽和鍵上。
- 2CoF3 + R-H → CoF2 + R-F + HF
參考資料
[編輯]- ^ 1.0 1.1 Coe, P. L. "Cobalt(III) Fluoride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ^ Arthur W. Chester, El-Ahmadi Heiba, Ralph M. Dessau, and William J. Koehl Jr. (1969): "The interaction of cobalt(III) with chloride ion in acetic acid". Inorganic and Nuclear Chemistry Letters, volume 5, issue 4, pages 277-283. doi:10.1016/0020-1650(69)80198-4
- ^ Priest, H. F. 「Anhydrous Metal Fluorides」 Inorganic Syntheses McGraw-Hill: New York, 1950; Vol. 3, pages 171-183.
- ^ Coe, P. L. "Potassium Tetrafluorocobaltate(III)" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.