锗
即使地球表面上锗的丰度地壳蕴含量相对较高,但由于矿石中很少含有高浓度的锗,所以它在化学史上发现得比较晚。德米特里·伊万诺维奇·门捷列夫在1869年根据元素周期表的位置,预测到锗的存在与其各项属性,并把它称作eka-矽。克莱门斯·温克勒于1886年在一种叫硫银锗矿的稀有矿物中,除了找到硫和银之外,还发现了一种新元素。尽管这种新元素的外观跟砷和锑有点像,但是新元素在化合物中的化合比符合硅下元素的预测。温克勒以他的国家——德国的拉丁语名来为这种元素命名。
锗是一种重要的半导体材料,用于制造晶体管及各种电子装置。主要的终端应用为光纤系统与红外线光学,也用于聚合反应的催化剂,制造电子器件与太阳能电力等。现在,开采锗用的主要矿石是闪锌矿(锌的主要矿石),也可以在银、铅和铜中,用商业方式提取锗。一些锗化合物,如四氯化锗(GeCl4)和甲锗烷(GeH4),会刺激眼睛、皮肤、肺部与喉咙。
发现史
[编辑]门捷列夫于1869年发表了一份名为《化学元素周期律》的研究报告,当中预测了数种未知元素的存在,其中一种填补了碳族中硅及锡之间的空缺[5]。由于它在周期表的位置,门捷列夫把它命名为拟硅(Ekasilicon, Es),并将其原子量定为72。

1885年夏季,在萨克森王国弗赖堡附近的一个矿场,发现了一种新的矿物。由于这种矿物的含银量高,所以被命名为硫银锗矿[b]。克莱门斯·温克勒检验了这种矿物,并于1886年成功从中分离出一种与锑相似的元素[6]。在他发表成果之前,他原本打算用海王星来为新元素命名,因为在1846年被发现的海王星,数学理论也预测它的存在[c]。然而,镎(Neptunium)这个名字当时已被另一元素占用(不过不是今天叫镎的那种元素,它到1940年才被发现)[d],因此温克勒改用他的祖国——德国的拉丁语(germanium)来为元素命名[6]。由于锗跟砷和锑相近,所以它当时是否该出现在周期表上仍备受争论,不过它的性质与门捷列夫的拟硅很像,因此才确立了它在周期表的确实位置[6][7] 在发现后,萨克森的矿场再给了温克勒五百公斤的矿石,因此他能进行后续研究,并在1887年确立了这种新元素的化学性质[8][9][10]。他通过分析纯四氯化锗,得出锗的原子量为72.32,而德布瓦博德兰则通过比较该元素的火花光谱线,得出72.3[11]。
温克勒当时成功制备了几种新的锗化合物,包括氟化物、氯化物、硫化物、二氧化锗及四乙基锗,而四乙基锗则是第一种有机锗烷[9]。有了从这些化合物而来的物理数据——它们符合门捷列夫的预测——锗的发现成为了确认门捷列夫元素周期的重要证据。下表比较了预测与温克勒的数据[9]:
| 特性 | 拟硅(预测) | 锗 |
|---|---|---|
| 原子质量 | 72 | 72.59 |
| 密度(g/cm3) | 5.5 | 5.35 |
| 熔点(℃) | 高 | 947 |
| 颜色 | 灰色 | 灰色 |
| 氧化物种类 | 耐火(refractory)二氧化物 | 耐火二氧化物 |
| 氧化物密度(g/cm3) | 4.7 | 4.7 |
| 氧化物性质 | 弱碱 | 弱碱 |
| 氯化物熔点 | 100℃以下 | 86℃ (GeCl4) |
| 氯化物密度(g/cm3) | 1.9 | 1.9 |

直至1930年代末期,科学家们一直以为锗只是一种导电性差的金属[12]。因为它的半导体特性对电子元件来说是非常有价值的,所以到1945年锗成了一种有利可图的材料。在第二次世界大战期间的1941年,锗二极体就开始取代电子装置中的真空管[13][14]。它的第一项主要用途为制造萧特基二极体的接点,该二极体在二战期间用于雷达接收[12]。第一种矽锗合金诞生于1955年[15]。在1945年以前,锗的年产量只有几百千克,但到了1950年代末,世界年产量就已经达到40公吨[16]。
锗晶体管在1948年的出现[17],开启了固态电子无数的应用之门[18]。从1950年至1970年代初,这个领域为锗提供了增长中的市场,但之后晶体管、二极体和整流器都开始转用高纯度硅[19]。硅的电子特性比锗优越,但是所需的纯度就高得多——这样的纯度用早年的商业方法实在达不到[20]。
与此同时,光纤通讯网络、红外线夜视系统及聚合反应催化剂对锗的需求量正在急速增长[16]。这些终端应用代表了2000年锗用量的80%[19]。美国政府甚至把锗定为战略及关键材料,并因此于1987年下令国家防御储备中心存入132公吨的锗[16]。生产锗与硅不同的是,硅的产量只受生产力限制,而锗的产量则受开采来源的短缺所限制。正因如此,硅在1998年的价格为每千克10美元以下[16],而当时锗的价格达每千克1800美元[16]。
特性
[编辑]在标准状况下,锗是一种银白色的半金属元素,硬但易碎[21]。这种形式构成一种同素异形体,技术上叫α锗,它带金属光泽,结构与钻石一样,为钻石立方晶体结构[19]。当压力高于120kPa时,会形成另一种同素异形体,叫β锗,它的结构与β锡一样[22]。与硅、镓、铋、锑与水一样,锗在熔化态固体化时(即凝固)会膨胀[22],而有这种特性的物质并不多。
锗是一种半导体。用区熔技术生产出的半导体用锗晶体,其杂质含量只有一百亿分之一[23],因此这种晶体是史上最纯的材料之一[24]。第一种在极强电磁场下成为超导体的金属材料,是一种含锗、铑和铀的合金,于2005年被发现[25]。
已知纯锗能自发地挤出非常长螺旋位错,叫“锗须”。这些晶须的增长,是较旧的锗制二极体和晶体管坏掉的主要原因,因为晶须很可能会构成短路,但短路与否视最终接触到的物质而定[25]。
化学性质
[编辑]
在250℃时,锗会缓慢地氧化成GeO2[26]。锗不溶于稀酸及碱,但溶于浓硫酸,并与熔碱反应,生成锗酸盐(GeO32-)。锗最常出现的氧化态是+4,但是已知它在不少化合物中的氧化态为+2[27]。其他的氧化态则很罕见,例如化合物Ge2Cl6中为+3,以及在氧化物表面测得的+3与+1氧化态[28],或者锗化物中的负氧化态,像是Mg
2Ge中的-4。多种含锗的阴性簇离子(津特耳离子)已经被制备出来,当中包括Ge42-、Ge94-、Ge92-及[(Ge9)2]6-,其中一种方法是在乙二胺或穴醚的催化下,从置于液态氨的锗与碱金属合金中进行提取[27][29]。这些离子中锗的氧化态并非整数——这点跟臭氧根离子中的氧一样。
已知锗共有两种氧化物:二氧化锗和一氧化锗[22]。焙烧二硫化锗(GeS2)后可得二氧化锗,二氧化锗是一种白色的粉末,微溶于水,但与碱反应并生成锗酸盐[22]。当二氧化锗与锗金属在高温下反应时,会生成一氧化锗[22]。二氧化锗(及其相关的氧化物及锗酸盐)有一种很不寻常的特性,就是对可见光有着高折射率,但同时对红外线隐形[30][31]。而锗酸铋则被用作闪铄器(scintillator)[32]。
锗还能与其它氧族元素生成二元化合物,例如二硫化物(GeS2)、二硒化物(GeSe2)、一硫化物(GeS)、一硒化物(GeSe)及碲化物(GeTe)[27]。把硫化氢气体通过含Ge(IV)的强酸溶液时,会生成白色沉淀物,即二硫化锗[27]。二硫化锗能很好地溶于水、苛性钠溶液及碱金属硫化物溶液中。但是,它不溶于酸性溶液,温克勒就是凭借这项性质才发现了锗[33]。把二硫化锗置于氢气流中加热,会生成一硫化锗(GeS),它升华后会形成一圈色暗但具金属光泽的薄层,它可溶于苛性钠溶液中。把一硫化锗、碱金属碳酸盐与硫一起加热后,会生成一种锗盐化合物,叫硫代锗酸盐[34]。

锗共有四种已知的四卤化物。在正常状况下四碘化锗(GeI4)为固体,四氟化锗(GeF4)为气体,其馀两种为挥发性液体。把锗与氯一块加热,会得到一种沸点为83.1℃的无色发烟液体,即四氯化锗[22]。锗的所有四卤化物都容易水解,生成带结晶水的二氧化锗[22]。四氯化锗用于制备有机锗化合物[27]。跟四卤化物相反的是,全部四种已知的二卤化物,皆为聚合固体[27]。另外已知的卤化物还包括Ge2Cl6及GenCl2n+2[22]。还有一种奇特的化合物Ge6Cl16,其中含有类似新戊烷结构的Ge5Cl12[35]。
甲锗烷(GeH4)是一种结构与甲烷相近的化合物。多锗烷(即与烷烃相似的锗化合物)的化学式为GenH2n+2,现时仍没有发现n大于五的多锗烷[27]。相对于硅烷,锗烷的挥发性和活性都较低[27]。GeH4在液态氨中与碱金属反应后,会产生白色的MGeH3晶体,当中含有GeH3−阴离子[27]。含一、二、三个卤素原子的氢卤化锗,皆为无色的活性液体[27]。

温克勒于1887年合成出第一种有机锗化合物(organogermanium compound);四氯化锗与二乙基锌反应生成四乙基锗(Ge(C2H5)4)[9]。R4Ge型(其中R为烃基)的有机锗烷,如四甲基锗(Ge(CH3)4)及四乙基锗,是由最便宜的锗前驱物四氯化锗及甲基亲核剂反应而成。有机锗氢化物,如异丁基锗烷((CH3)2CHCH2GeH3)的危险性比较低,因此半导体工业会用液体的氢化物来取代气体的甲锗烷。已知锗有不少活性中间物:锗代自由基、锗烯(与碳烯相近)和锗炔(与卡宾相近)[36][37]。有机锗化合物2-羧乙基锗倍半氧烷(2-carboxyethylgermasesquioxane),于1970年被发现,曾经有一段时间被用作膳食补充剂,当时认为它可能对肿瘤有疗效[38]。
同位素
[编辑]锗共有五种天然存在的同位素:70Ge、72Ge、73Ge、74Ge和76Ge。当中,76Ge带微弱的放射性,其衰变模式为双β衰变,半衰期为1.58 × 1021年。74Ge是最常见的同位素,丰度约为36%。76Ge的自然丰度是最低的,约为7%[39]。当72Ge被α粒子轰击时,会产生稳定的77Se,并在过程中释放出高能量的电子[40]。因此,它与氡组合后可用作核电池[40]。
锗最少有27种合成放射性同位素,各原子质量介乎58至89之间。当中最稳定的是68Ge,其衰变模式为电子捕获,半衰期则为270.95 d。而当中最不稳定的则是60Ge,其半衰期为30 ms。尽管大部份锗同位素的衰变模式皆为β衰变,但是也有例外。61Ge及64Ge的衰变模式为β+迟延质子发射(proton emission)[39],而84Ge至87Ge则有可能进行β-迟延中子发射[39]。
自然丰度
[编辑]锗是由恒星核合成所创造的,主要是透过渐近巨星分支上恒星内的S-过程。S-过程是一种慢中子捕获过程,发生于脉冲红巨星中的轻元素[41]。在木星的大气层中能探测到锗[42],在一些遥远的恒星中也能探测到锗[43]。锗在地球的地壳丰度约为1.6 ppm[44]。含锗量可观的矿石只有几种,如硫银锗矿、灰锗矿(briartitie)、硫锗铜矿(germanite)及硫锗铁铜矿(renierite),而它们都没有可供开采的矿床。尽管如此,开采这些矿石都不是为了它们所含的锗[19][45]。一些锌铜铅矿体的含锗量够高,因此可以从它们最终的浓缩矿物中提取锗[44]。
德国矿物学家威特·戈斯密(Victor Goldschmidt)在测量锗矿床时,发现了一种奇特的浓缩过程,它使得一些煤矿层能拥有高含锗量[46][47]。最高的含锗量出现在英国诺森伯兰郡哈特莱村(Hartley)的煤灰中,达1.6%[46][47]。内蒙古锡林浩特市附近的煤矿层含锗量估计达1600公吨[44]。
制备
[编辑]
2007年锗的年生产量约为100公吨[19]。现在,主要的方法是从锗浓度达0.3%的闪锌矿中提取锗[48],它是当中的副产品,这种矿石最常出现于以沉积物为主体的大型Zn-Pb-Cu(-Ba)矿床,及以碳酸盐为主体的Zn-Pb矿床[44]。尽管没有全球锗储备量的确实数字,但是估计美国的储备量约在500公吨左右[44]。在2007年,锗的需求量有35%是由循环再造所满足[44]。
锗主要是由闪锌矿中制取,而闪锌矿是一种锌矿石,但是也可以在银、铅及铜矿中找到锗。若煤炭发电厂用的煤是从高锗浓度的矿床来的话,那么发电厂的飞灰(fly ash)也是锗的一个来源。俄罗斯与中国都有在用这种锗源[49]。俄罗斯的锗矿床位于其远东的库页岛,而海参崴东北的煤矿也被用作锗源[44]。中国的锗矿床主要位于云南省临沧市的褐煤矿场,及内蒙古自治区锡林浩特市附近的煤矿,而它们都是开采中的锗源[44]。
| 年份 | 价格 ($/kg)[50] |
|---|---|
| 1999 | 1,400 |
| 2000 | 1,250 |
| 2001 | 890 |
| 2002 | 620 |
| 2003 | 380 |
| 2004 | 600 |
| 2005 | 660 |
| 2006 | 880 |
| 2007 | 1,240 |
| 2008 | 1,490 |
| 2009 | 950 |
锗的大部份浓缩矿物为硫化物;它们在空气中加热后会变成氧化物,这个过程叫焙烧(roasting):
- GeS2 + 3O2 → GeO2 + 2SO2
在这个过程中,部份锗会进到所产生的灰尘中,而剩下的锗则被转化成锗酸盐,然后被硫酸淋溶,此时在炉渣中的锌也被淋溶。在中和反应后,只有锌留在溶液中,沉淀物中含有锗及其他金属。在用威尔兹冶锌法(Waelz process)把沉淀物中的含锌量减少后,而残馀的威尔兹氧化物则接受第二次淋溶。此时从沉淀物中可得二氧化锗,与氯气或氯化氢反应后被转化成四氯化锗,由于它的沸点低,因此可用蒸馏法进行分离[49] :
- GeO2 + 4HCl → GeCl4 + 2H2O
- GeO2 + 2Cl2 → GeCl4 + O2
四氯化锗会被水解成二氧化锗,或用分馏法净化后再被水解[49]。极纯的GeO2适用于制造锗玻璃。纯二氧化锗与氢反应后被还原成锗,用这种还原方式所得的锗,适用于红外线光学或半导体工业:
- GeO2 + 4H2 → Ge + 2H2O
用于钢铁生产及其他工业过程的锗,一般会用碳来还原[51]:
- GeO2 + C → Ge + CO2
应用
[编辑]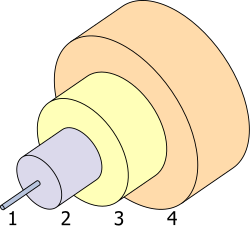
1. 核心 8 µm
2. 包层 125 µm
3. 缓冲层 250 µm
4. 护套 400 µm
锗在2007年的估计全球终端应用为:光纤系统占35%,红外线光学(infrared optics)占30%,聚合催化剂占15%,及电子和太阳能发电也占15%[19]。馀下的5%为其他应用,如磷光体(phosphor)、冶金及化学治疗[19]。
光学
[编辑]二氧化锗最值得注意的物理特性,就是它的高折射率,和低色散。因此特别适用于广角镜、显微镜和光纤核心[52][53]。它更取代了二氧化钛,成为了二氧化硅光纤核心的掺杂物,这样就不用再做后续热处理,而这种处理会使光纤变得易碎[54]。在2002年末,光纤工业占美国锗用量的60%,但只占全球用量不到10%[53]。锗锑碲(GeSbTe)是一种相变合金,以其光学特性著称,应用例子包括可重写光盘[55]。
由于红外线可以无损失的穿透锗,因此它成了一种重要的红外线光学材料,能很容易地被切割或打磨成镜片及窗户。它在红外线光学中的一项重要应用,就是制作热图像照相机(thermal imaging camera)的镜头涂层。含锗的这一种镜头用于波长为8至14微米的红外线,这样的红外线可用于被动热成像及热点探测,因此能被应用于军事、汽车夜视系统及消防[51]。这样的镜头还能用于显微镜光谱仪,及其他需要极敏感红外线探测的光学仪器[53]。锗这种材料有着非常高的折射率(4.0),因此需要抗反射涂层。特别是类金刚石碳的抗反射涂层,这是一种特别坚硬的特殊涂层,其折射率为2.0,与锗相若,而且会产生一层如钻石坚硬的表面,足以面对户外的各种严苛环境[56][57]。
电子工业
[编辑]晶体管主要由锗和硅两种高纯度半导体制作,而锗晶体管(简称锗管)曾是晶体管时代早期(于40年代末开始)最重要的半导体产品,因为当时制作高纯硅和制造硅管的工艺都不够成熟。锗晶体管相比硅管,有B-E结压降低(锗管约0.2V,而硅管为0.6V左右)的优势,但是热稳定性较差,且响应速度的极限明显不如硅管。锗管的大规模应用大概持续到1970年左右,此后从发达国家开始逐渐淘汰,到1980年,几乎在全世界范围完全被硅管取代而退出电子工业[58]。然而,一些音响发烧友认为锗管具有独特的音色,相对于硅管的“冷硬”,锗管温暖醇厚的声音特性被一些玩家称为‘低压电子管’[59]因此一些生产于60年代的电声设备和零件至今受到部分玩家的追捧,一些音乐用的踏板效果器还在用锗晶体管,因为这种效果器能产生早期摇滚特有的“模糊”音质,当中最有名的是Dallas Arbiter公司所生产的Fuzz Face效果器[60]。
后来电子材料界又燃起了对锗材料的兴趣,不过已不局限于纯锗晶体。锗化硅合金(一般称为“硅锗”)正急速地成为一种重要的半导体材料,用于高速集成电路。使用了Si-SiGe接面的电路,由于这种接面的特性,而比只用Si的要快得多[61]。在无线通讯(wireless communication)装置中,锗化硅正开始取代砷化镓[19]。有着高速特性的SiGe晶片,可以用硅晶片工业传统的生产技巧,并以低廉的成本生产[19]。
随著能源成本的上涨,使得太阳能板的经济价值有所提高,而这也是锗的一大潜在应用[19]。锗是太空用高效多结光伏电池的晶圆基板。因为锗的晶格常数(lattice constant)与砷化镓相近,所以可以用锗基板来制造砷化镓太阳能电池[62]。火星探测漫游者及数个人造卫星,都有使用锗上三联点砷化镓电池[63]。
上锗下绝缘体的基板,有望可以取代微型晶片中的硅[19]。其他电子应用还包括萤光灯的磷光体(phosphor)[23],及锗基固态发光二极体[19]。
其他应用
[编辑]在生产聚对苯二甲酸乙二酯的过程中,二氧化锗还可以用于催化聚合作用[64]。这样生产出来的成品耀度很高,所以在日本销售的PET瓶子都专门选用这一种聚酯[64]。然而,美国不把锗用作聚合催化剂[19]。由于二氧化硅与二氧化锗相近,所以气相色谱柱中的固定相二氧化硅,可用二氧化锗来取代[65]。
近年,在贵金属合金中加入锗是愈来愈多。例如,在英币标准银(sterling silver)(含银量达95%以上的合金)中加入锗,就能减少火纹(firescale)、增加抗锈色性(tarnish)及增加对析出硬化(precipitation hardening)的反应。有一种抗锈色的银合金,商标名叫Argentium,其含锗量需达1.2%[19]。
高纯度锗单晶探测器,能准确地探测出辐射的来源,因此可用于机场保安系统[66]。锗亦被用于晶体单光仪(crystal monochromator),这台仪器能生成单晶中子散射(neutron scattering)及同步X射线绕射所需的线性束。在中子及高能X射线的应用,锗的反射性比硅优胜[67]。高纯度的锗晶体还被用于伽玛光谱学(gamma spectroscopy)和探寻暗物质的探测器中[68]。
锗的一些化合物对哺乳类动物没甚么毒性,可是对某些细菌则有着相当的毒性[21]。就因为这项特性,所以这些锗化合物可用作化学治疗剂[69]。
对生物的影响
[编辑]一般认为锗对动植物的健康并不重要。[70]由于锗在矿石与碳质材料中是一种稀有元素,加上在商业应用中使用的量也不算多,所以它对自然并没有甚么影响[19]。
锗化合物被用于白血病与肺癌的替代疗法[16],但没有医学实证证实锗的好处,甚至有证据表明它们有害[70]。美国食品药品监督管理局的研究结论认为,当锗被用作膳食补充剂时“有可能危害人体健康”[38]。
锗本身不危险,但某些活泼的锗化合物有毒。[71]例如四氯化锗及甲锗烷,分别为液体及气体,能对眼睛、皮肤、肺部及喉咙造成很大的刺激[72]。有些锗化合物对哺乳动物的毒性低,但对细菌来说有毒。[21]
参见
[编辑]注释
[编辑]- ^ “鈤”亦为化学元素镭的旧译,因造成混淆而采用新译。[73]
- ^ 在希腊语中,Argyrodite一词有“含银”的意思[74]。
- ^ 跟预测到新元素的存在一样,数学家亚当斯与勒威耶,利用天王星轨道被拉出去的偏差,在1843年前后就预测到行星海王星的存在[75]。查理士(James Challis)于1846年8月开始搜寻第八颗行星[76],而加勒则于1846年9月23日正式观测到它[77]。
- ^ 赫尔曼(R. Hermann)在1877年声称发现周期素中位于钽下的元素,并以罗马神话海王尼普顿命名为镎(Naptunium)[78][79]。但后来发现这种金属只是元素铌与钽的合金[80]。很久以后,镎这个名字给了在周期表位于铀下的合成元素,它是由核物理学家在1940年所发现[81] 。
参考资料
[编辑]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2012-01-12., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ 3.0 3.1 3.2 3.3 Properties of Germanium. Ioffe Institute. (原始内容存档于2012-01-25).
- ^ M. Agostini; et al. Final Results of GERDA on the Two-Neutrino Double-β Decay Half-Life of 76Ge. Physical Review Letters (American Physical Society (APS)). 2023-10-03, 131 (14). ISSN 0031-9007. doi:10.1103/physrevlett.131.142501.
- ^ Kaji, Masanori. D. I. Mendeleev's concept of chemical elements and The Principles of Chemistry (PDF). Bulletin for the History of Chemistry. 2002, 27 (1): 4–16 [2008-08-20]. (原始内容 (pdf)存档于2008-12-17).
- ^ 6.0 6.1 6.2 Winkler, Clemens. Germanium, Ge, a New Nonmetal Element (English translation[失效链接]). Berichte der deutschen chemischen Gesellschaft. 1887, 19 (1): 210–211. doi:10.1002/cber.18860190156. (原始内容存档于2012-10-13) (德语).
- ^ Germanium, a New Non-Metallic Element. The Manufacturer and Builder. 1887: 181 [2008-08-20]. (原始内容存档于2008-12-19).
- ^ Winkler, Clemens. Mittheilungen über das Germanium. J. Prak. Chemie. 1886, 34: 177–229. doi:10.1002/prac.18860340122. (原始内容存档于2012-11-03) (德语).
- ^ 9.0 9.1 9.2 9.3 Winkler, Clemens. Mittheilungen über des Germanium. Zweite Abhandlung. J. Prak. Chemie. 1887, 36: 177–209 [2008-08-20]. doi:10.1002/prac.18870360119. (原始内容存档于2012-11-03) (德语).
- ^ Brunck, O. Obituary: Clemens Winkler. Berichte der deutschen chemischen Gesellschaft. 1886, 39 (4): 4491–4548. doi:10.1002/cber.190603904164 (德语).
- ^ de Boisbaudran, M. Lecoq. Sur le poids atomique du germanium. Comptes rendus. 1886, 103: 452 [2008-08-20]. (原始内容存档于2013-06-20) (法语).
- ^ 12.0 12.1 Haller, E. E. Germanium: From Its Discovery to SiGe Devices (pdf). Department of Materials Science and Engineering, University of California, Berkeley, and Materials Sciences Division, Lawrence Berkeley National Laboratory, Berkeley,. [2008-08-22]. (原始内容存档 (PDF)于2019-07-10).
- ^ W. K. Germanium for Electronic Devices. NY Times. 1953 [2008-08-22]. (原始内容存档于2013-06-13).
- ^ 1941 - Semiconductor diode rectifiers serve in WW II. Computer History Museum. [2008-08-22]. (原始内容存档于2008-09-24).
- ^ SiGe History. University of Cambridge. [2008-08-22]. (原始内容存档于2008-08-05).
- ^ 16.0 16.1 16.2 16.3 16.4 16.5 Halford, Bethany. Germanium. Chemical & Engineering News (American Chemical Society). 2003 [2008-08-22]. (原始内容存档于2008-05-13).
- ^ Bardeen, J.; Brattain, W. H. The Transistor, A Semi-Conductor Triode. Physical Reviews. 1948, 74: 230–231. doi:10.1103/PhysRev.74.230.
- ^ Electronics History 4 - Transistors. National Academy of Engineering. [2008-08-22]. (原始内容存档于2007-10-20).
- ^ 19.00 19.01 19.02 19.03 19.04 19.05 19.06 19.07 19.08 19.09 19.10 19.11 19.12 19.13 19.14 U.S. Geological Survey. Germanium—Statistics and Information. U.S. Geological Survey, Mineral Commodity Summaries. 2008 [2008-08-28]. (原始内容存档于2008-09-16).
Select 2008
- ^ Teal, Gordon K. Single Crystals of Germanium and Silicon-Basic to the Transistor and Integrated Circuit (PDF). IEEE Transactions on Electron Devices. July 1976, ED–23 (7): 621–639. doi:10.1109/T-ED.1976.18464.[失效链接]
- ^ 21.0 21.1 21.2 Emsley, John. Nature's Building Blocks. Oxford: Oxford University Press. 2001: 506–510. ISBN 0-19-850341-5. 引用错误:带有name属性“nbb”的
<ref>标签用不同内容定义了多次 - ^ 22.0 22.1 22.2 22.3 22.4 22.5 22.6 22.7 Holleman, A. F.; Wiberg, E.; Wiberg, N. Lehrbuch der Anorganischen Chemie 102. de Gruyter. 2007. ISBN 978-3-11-017770-1. OCLC 145623740.
- ^ 23.0 23.1 Germanium. Los Alamos National Laboratory. [2008-08-28]. (原始内容存档于2008-06-10).
- ^ Chardin, B. Dark Matter: Direct Detection. Binetruy, B. (编). The Primordial Universe: 28 June - 23 July 1999. Springer. 2001: 308. ISBN 3540410465.
- ^ 25.0 25.1 Lévy, F.; Sheikin, I.; Grenier, B.; Huxley, Ad. Magnetic field-induced superconductivity in the ferromagnet URhGe. Science. 2005-08, 309 (5739): 1343–1346. PMID 16123293. doi:10.1126/science.1115498.
- ^ Tabet, N. KRXPS study of the oxidation of Ge(001) surface. Applied Surface Science. 1998, 134: 275. doi:10.1016/S0169-4332(98)00251-7.
- ^ 27.00 27.01 27.02 27.03 27.04 27.05 27.06 27.07 27.08 27.09 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Tabet, N. XPS study of the growth kinetics of thin films obtained by thermal oxidation of germanium substrates. Journal of Electron Spectroscopy and Related Phenomena. 1999,. 101-103: 233. doi:10.1016/S0368-2048(98)00451-4.
- ^ Xu, Li; Sevov, Slavi C. Oxidative Coupling of Deltahedral [Ge9]4− Zintl Ions. J. Am. Chem. Soc. 1999, 121 (39): 9245–9246. doi:10.1021/ja992269s.
- ^ Bayya, Shyam S.; Sanghera, Jasbinder S.; Aggarwal, Ishwar D.; Wojcik, Joshua A. Infrared Transparent Germanate Glass-Ceramics. Journal of the American Ceramic Society. 2002, 85 (12): 3114–3116.
- ^ Drugoveiko, O. P. Infrared reflectance and transmission spectra of germanium dioxide and its hydrolysis products. Journal of Applied Spectroscopy. 1975, 22: 191. doi:10.1007/BF00614256.
- ^ Lightstone, A. W.; McIntyre, R. J.; Lecomte, R.; Schmitt, D. A Bismuth Germanate-Avalanche Photodiode Module Designed for Use in High Resolution Positron Emission Tomography. IEEE Transactions on Nuclear Science. 1986, 33 (1): 456–459. doi:10.1109/TNS.1986.4337142.
- ^ Johnson, Otto H. Germanium and its Inorganic Compounds. Chem. Rev. 1952, 3: 431 – 431. doi:10.1021/cr60160a002.
- ^ Fröba, Michael. First synthesis of mesostructured thiogermanates. Chemical Communications. 1997: 1729. doi:10.1039/a703634e.
- ^ Beattie, I.R.; Jones, P.J.; Reid, G.; Webster, M. The Crystal Structure and Raman Spectrum of Ge5Cl12·GeCl4 and the Vibrational Spectrum of Ge2Cl6. Inorg. Chem. 1998, 37 (23): 6032–6034. doi:10.1021/ic9807341.
- ^ Satge, Jacques. Reactive intermediates in organogermanium chemistry. Pure & Appl. Chem. 1984, 56 (1): 137–150. doi:10.1351/pac198456010137.
- ^ Quane, Denis; Bottei, Rudolph S. Organogermanium Chemistry. Chemical Reviews. 1963, 63 (4): 403–442. doi:10.1021/cr60224a004.
- ^ 38.0 38.1 Tao, S. H.; Bolger, P. M. Hazard Assessment of Germanium Supplements. Regulatory Toxicology and Pharmacology. June 1997, 25 (3): 211–219. doi:10.1006/rtph.1997.1098.
- ^ 39.0 39.1 39.2 Audi, G. Nubase2003 Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center). 2003, 729: 3–128. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ 40.0 40.1 Alpha Fusion Electrical Energy Valve (PDF). Nu Energy Research Institute. [2008-09-10]. (原始内容 (pdf)存档于2008-10-01).
- ^ Sterling, N. C.; Dinerstein, Harriet L.; Bowers, Charles W. Discovery of Enhanced Germanium Abundances in Planetary Nebulae with the Far Ultraviolet Spectroscopic Explorer. The Astrophysical Journal Letters. 2002, 578: L55–L58. doi:10.1086/344473.
- ^ Kunde, V.; Hanel, R.; Maguire, W.; Gautier, D.; Baluteau, J. P.; Marten, A.; Chedin, A.; Husson, N.; Scott, N. The tropospheric gas composition of Jupiter's north equatorial belt /NH3, PH3, CH3D, GeH4, H2O/ and the Jovian D/H isotopic ratio. Astrophysical J. 1982, 263: 443–467. doi:10.1086/160516.
- ^ Cowan, John. Astronomy: Elements of surprise. Nature. 2003-05-01, 423 (29): 29. doi:10.1038/423029a.
- ^ 44.0 44.1 44.2 44.3 44.4 44.5 44.6 44.7 Höll, R.; Kling, M.; Schroll, E. Metallogenesis of germanium—A review. Ore Geology Reviews. 2007, 30 (3–4): 145–180. doi:10.1016/j.oregeorev.2005.07.034.
- ^ Lifton, Jack. Byproducts II: Another Germanium Rush?. Resource Investor.com. 2007-04-26 [2008-09-09]. (原始内容存档于2007-06-12).
- ^ 46.0 46.1 Goldschmidt, V. M. Ueber das Vorkommen des Germaniums in Steinkohlen und Steinkohlenprodukten. Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse. 1930: 141–167 [2012-10-16]. (原始内容存档于2008-12-01).
- ^ 47.0 47.1 Goldschmidt, V. M.; Peters, Cl. Zur Geochemie des Germaniums. Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse. 1933: 141–167 [2012-10-16]. (原始内容存档于2008-12-01).
- ^ Bernstein, L. Germanium geochemistry and mineralogy. Geochimica et Cosmochimica Acta. 1985, 49: 2409. doi:10.1016/0016-7037(85)90241-8.
- ^ 49.0 49.1 49.2 Naumov, A. V. World market of germanium and its prospects. Russian Journal of Non-Ferrous Metals. 2007, 48 (4): 265–272. doi:10.3103/S1067821207040049.
- ^ R.N. Soar. USGS Minerals Information. U.S. Geological Survey Mineral Commodity Summaries. 1977. 2003-01, 2004-01, 2005-01, 2006-01, 2007-01, January 2010 [2013-04-22]. ISBN 978-0-85934-039-7. OCLC 16437701. (原始内容存档于2013-05-07).
- ^ 51.0 51.1 Moskalyk, R. R. Review of germanium processing worldwide. Minerals Engineering. 2004, 17: 393–402. doi:10.1016/j.mineng.2003.11.014.
- ^ Rieke, G.H. Infrared Detector Arrays for Astronomy. Annu. Rev. Astro. Astrophys. 2007, 45: 77. doi:10.1146/annurev.astro.44.051905.092436.
- ^ 53.0 53.1 53.2 Brown, Jr., Robert D. Germanium (pdf). U.S. Geological Survey. 2000 [2008-09-22]. (原始内容存档 (PDF)于2011-08-22).
- ^ Chapter III: Optical Fiber For Communications. Stanford Research Institute. [2008-08-22]. (原始内容存档于2006-06-15).
- ^ Understanding Recordable & Rewritable DVD First Edition (PDF). Optical Storage Technology Association (OSTA). [2008-09-22]. (原始内容 (pdf)存档于2009-04-19).
- ^ Lettington, Alan H. Applications of diamond-like carbon thin films. Carbon. 1998, 36 (5–6): 555–560. doi:10.1016/S0008-6223(98)00062-1.
- ^ Gardos, Michael N.; Soriano, Bonnie L.; Propst, Steven H. Study on correlating rain erosion resistance with sliding abrasion resistance of DLC on germanium. Proc. SPIE,. 1990, 1325 (Mechanical Properties): 99. doi:10.1117/12.22449.
- ^ 存档副本 (PDF). [2016-06-02]. (原始内容 (PDF)存档于2016-08-07).
- ^ 存档副本. [2016-06-02]. (原始内容存档于2017-03-05).
- ^ Szweda, Roy. Germanium phoenix. III-Vs Review. 2005, 18 (7): 55. doi:10.1016/S0961-1290(05)71310-7.
- ^ Washio, K. SiGe HBT and BiCMOS technologies for optical transmission and wireless communication systems. IEEE Transactions on Electron Devices. 2003, 50: 656. doi:10.1109/TED.2003.810484.
- ^ Bailey, Sheila G. Space and terrestrial photovoltaics: synergy and diversity. Progress in Photovoltaics Research and Applications. 2002, 10: 399. doi:10.1002/pip.446.
- ^ Crisp, D.; Pathare, A.; Ewell, R. C. The performance of gallium arsenide/germanium solar cells at the Martian surface. Progress in Photovoltaics Research and Applications. 2004, 54 (2): 83–101. doi:10.1016/S0094-5765(02)00287-4.
- ^ 64.0 64.1 Thiele, Ulrich K. The Current Status of Catalysis and Catalyst Development for the Industrial Process of Poly(ethylene terephthalate) Polycondensation. International Journal of Polymeric Materials. 2001, 50 (3): 387 – 394. doi:10.1080/00914030108035115.
- ^ Fang, Li; Kulkarni, Sameer; Alhooshani, Khalid; Malik, Abdul. Germania-Based, Sol-Gel Hybrid Organic-Inorganic Coatings for Capillary Microextraction and Gas Chromatography. Anal. Chem. 2007, 79 (24): 9441–9451. doi:10.1021/ac071056f.
- ^ Keyser, Ronald; Twomey, Timothy; Upp, Daniel. Performance of Light-Weight, Battery-Operated, High Purity Germanium Detectors for Field Use (PDF). Oak Ridge Technical Enterprise Corporation (ORTEC). [2008-09-06]. (原始内容 (pdf)存档于2007-10-26).
- ^ Ahmed, F. U. Optimization of Germanium for Neutron Diffractometers. International Journal of Modern Physics E. 1996, 5: 131. doi:10.1142/S0218301396000062.
- ^ Diehl, R. Astrophysical constraints from gamma-ray spectroscopy. Nuclear Physics A. 2006, 777: 70. doi:10.1016/j.nuclphysa.2005.02.155.
- ^ Slavik, Milan; Blanc, Oscar; Davis, Joan. Spirogermanium: A new investigational drug of novel structure and lack of bone marrow toxicity. Investigational New Drugs. 1983, 1 (3): 225–234. doi:10.1007/BF00208894.
- ^ 70.0 70.1 Germanium. American Cancer Society. [2008-08-31]. (原始内容存档于2008-06-10).
- ^ Brown, Robert D. Jr. Commodity Survey:Germanium (PDF) (报告). US Geological Surveys. [2008-09-09]. (原始内容存档 (PDF)于2018-03-04).
- ^ Gerber, G.B.; Léonard, A. Mutagenicity, carcinogenicity and teratogenicity of germanium compounds. Regulatory Toxicology and Pharmacology. 1997, 387: 141–146. doi:10.1016/S1383-5742(97)00034-3.
- ^ 鈤. 教育部《异体字字典》. (原始内容存档于2015-06-20).
- ^ Argyrodite—Ag
8GeS
6 (pdf) (报告). Mineral Data Publishing. [2008-09-01]. (原始内容存档 (PDF)于2008-12-19). - ^ Adams, J. C. Explanation of the observed irregularities in the motion of Uranus, on the hypothesis of disturbance by a more distant planet. Monthly Notices of the Royal Astronomical Society (Blackwell Publishing). November 13, 1846, 7: 149 [2008-02-18]. (原始内容存档于2016-01-10).
- ^ Challis, Rev. J. Account of observations at the Cambridge observatory for detecting the planet exterior to Uranus. Monthly Notices of the Royal Astronomical Society (Blackwell Publishing). November 13, 1846, 7: 145–149 [2008-02-18]. (原始内容存档于2016-01-10).
- ^ Galle, J. G. Account of the discovery of the planet of Le Verrier at Berlin. Monthly Notices of the Royal Astronomical Society. 13 November 1846, 7: 153. Bibcode:1846MNRAS...7..153G.
- ^ Sears, Robert. Scientific Miscellany. The Galaxy (Columbus, O[hio]: Siebert & Lilley). 1877-07, 24 (1): 131. ISBN 0665501668. OCLC 16890343.
- ^ Editor's Scientific Record. Harper's new monthly magazine. 1877-06, 55 (325): 152–153 [2012-10-09]. (原始内容存档于2012-05-26).
- ^ van der Krogt, Peter. Elementymology & Elements Multidict: Niobium. [2008-08-20]. (原始内容存档于2008-09-22).
- ^ Westgren, A. The Nobel Prize in Chemistry 1951: presentation speech. Nobel Lectures, Chemistry 1942-1962. Elsevier. 1964. (原始内容存档于2008-12-10).
外部链接
[编辑]- 元素锗在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 锗(英文)
- 元素锗在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素锗在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 锗(英文)



