鍺
即使地球表面上鍺的豐度地殼蘊含量相對較高,但由於礦石中很少含有高濃度的鍺,所以它在化學史上發現得比較晚。德米特里·伊萬諾維奇·門捷列夫在1869年根據元素週期表的位置,預測到鍺的存在與其各項屬性,並把它稱作eka-矽。克萊門斯·溫克勒於1886年在一種叫硫銀鍺礦的稀有礦物中,除了找到硫和銀之外,還發現了一種新元素。儘管這種新元素的外觀跟砷和銻有點像,但是新元素在化合物中的化合比符合矽下元素的預測。溫克勒以他的國家——德國的拉丁語名來為這種元素命名。
鍺是一種重要的半導體材料,用於製造電晶體及各種電子裝置。主要的終端應用為光纖系統與紅外線光學,也用於聚合反應的催化劑,製造電子元件與太陽能電力等。現在,開採鍺用的主要礦石是閃鋅礦(鋅的主要礦石),也可以在銀、鉛和銅中,用商業方式提取鍺。一些鍺化合物,如四氯化鍺(GeCl4)和甲鍺烷(GeH4),會刺激眼睛、皮膚、肺部與喉嚨。
發現史
[編輯]門捷列夫於1869年發表了一份名為《化學元素週期律》的研究報告,當中預測了數種未知元素的存在,其中一種填補了碳族中矽及錫之間的空缺[5]。由於它在週期表的位置,門捷列夫把它命名為擬矽(Ekasilicon, Es),並將其原子量定為72。

1885年夏季,在薩克森王國弗賴堡附近的一個礦場,發現了一種新的礦物。由於這種礦物的含銀量高,所以被命名為硫銀鍺礦[b]。克萊門斯·溫克勒檢驗了這種礦物,並於1886年成功從中分離出一種與銻相似的元素[6]。在他發表成果之前,他原本打算用海王星來為新元素命名,因為在1846年被發現的海王星,數學理論也預測它的存在[c]。然而,錼(Neptunium)這個名字當時已被另一元素佔用(不過不是今天叫錼的那種元素,它到1940年才被發現)[d],因此溫克勒改用他的祖國——德國的拉丁語(germanium)來為元素命名[6]。由於鍺跟砷和銻相近,所以它當時是否該出現在週期表上仍備受爭論,不過它的性質與門捷列夫的擬矽很像,因此才確立了它在週期表的確實位置[6][7] 在發現後,薩克森的礦場再給了溫克勒五百公斤的礦石,因此他能進行後續研究,並在1887年確立了這種新元素的化學性質[8][9][10]。他通過分析純四氯化鍺,得出鍺的原子量為72.32,而德布瓦博德蘭則通過比較該元素的火花光譜線,得出72.3[11]。
溫克勒當時成功製備了幾種新的鍺化合物,包括氟化物、氯化物、硫化物、二氧化鍺及四乙基鍺,而四乙基鍺則是第一種有機鍺烷[9]。有了從這些化合物而來的物理數據——它們符合門捷列夫的預測——鍺的發現成為了確認門捷列夫元素週期的重要證據。下表比較了預測與溫克勒的數據[9]:
| 特性 | 擬矽(預測) | 鍺 |
|---|---|---|
| 原子質量 | 72 | 72.59 |
| 密度(g/cm3) | 5.5 | 5.35 |
| 熔點(℃) | 高 | 947 |
| 顏色 | 灰色 | 灰色 |
| 氧化物種類 | 耐火(refractory)二氧化物 | 耐火二氧化物 |
| 氧化物密度(g/cm3) | 4.7 | 4.7 |
| 氧化物性質 | 弱鹼 | 弱鹼 |
| 氯化物熔點 | 100℃以下 | 86℃ (GeCl4) |
| 氯化物密度(g/cm3) | 1.9 | 1.9 |

直至1930年代末期,科學家們一直以為鍺只是一種導電性差的金屬[12]。因為它的半導體特性對電子元件來說是非常有價值的,所以到1945年鍺成了一種有利可圖的材料。在第二次世界大戰期間的1941年,鍺二極體就開始取代電子裝置中的真空管[13][14]。它的第一項主要用途為製造蕭特基二極體的接點,該二極體在二戰期間用於雷達接收[12]。第一種矽鍺合金誕生於1955年[15]。在1945年以前,鍺的年產量只有幾百千克,但到了1950年代末,世界年產量就已經達到40公噸[16]。
鍺電晶體在1948年的出現[17],開啟了固態電子無數的應用之門[18]。從1950年至1970年代初,這個領域為鍺提供了增長中的市場,但之後電晶體、二極體和整流器都開始轉用高純度矽[19]。矽的電子特性比鍺優越,但是所需的純度就高得多——這樣的純度用早年的商業方法實在達不到[20]。
與此同時,光纖通訊網絡、紅外線夜視系統及聚合反應催化劑對鍺的需求量正在急速增長[16]。這些終端應用代表了2000年鍺用量的80%[19]。美國政府甚至把鍺定為戰略及關鍵材料,並因此於1987年下令國家防禦儲備中心存入132公噸的鍺[16]。生產鍺與矽不同的是,矽的產量只受生產力限制,而鍺的產量則受開採來源的短缺所限制。正因如此,矽在1998年的價格為每千克10美元以下[16],而當時鍺的價格達每千克1800美元[16]。
特性
[編輯]在標準狀況下,鍺是一種銀白色的半金屬元素,硬但易碎[21]。這種形式構成一種同素異形體,技術上叫α鍺,它帶金屬光澤,結構與鑽石一樣,為鑽石立方晶體結構[19]。當壓強高於120kPa時,會形成另一種同素異形體,叫β鍺,它的結構與β錫一樣[22]。與矽、鎵、鉍、銻與水一樣,鍺在熔化態固體化時(即凝固)會膨脹[22],而有這種特性的物質並不多。
鍺是一種半導體。用區熔技術生產出的半導體用鍺晶體,其雜質含量只有一百億分之一[23],因此這種晶體是史上最純的材料之一[24]。第一種在極強電磁場下成為超導體的金屬材料,是一種含鍺、銠和鈾的合金,於2005年被發現[25]。
已知純鍺能自發地擠出非常長螺旋位錯,叫「鍺鬚」。這些晶鬚的增長,是較舊的鍺製二極體和電晶體壞掉的主要原因,因為晶鬚很可能會構成短路,但短路與否視最終接觸到的物質而定[25]。
化學性質
[編輯]
在250℃時,鍺會緩慢地氧化成GeO2[26]。鍺不溶於稀酸及鹼,但溶於濃硫酸,並與熔鹼反應,生成鍺酸鹽(GeO32-)。鍺最常出現的氧化態是+4,但是已知它在不少化合物中的氧化態為+2[27]。其他的氧化態則很罕見,例如化合物Ge2Cl6中為+3,以及在氧化物表面測得的+3與+1氧化態[28],或者鍺化物中的負氧化態,像是Mg
2Ge中的-4。多種含鍺的陰性簇離子(津特耳離子)已經被製備出來,當中包括Ge42-、Ge94-、Ge92-及[(Ge9)2]6-,其中一種方法是在乙二胺或穴醚的催化下,從置於液態氨的鍺與鹼金屬合金中進行提取[27][29]。這些離子中鍺的氧化態並非整數——這點跟臭氧根離子中的氧一樣。
已知鍺共有兩種氧化物:二氧化鍺和一氧化鍺[22]。焙燒二硫化鍺(GeS2)後可得二氧化鍺,二氧化鍺是一種白色的粉末,微溶於水,但與鹼反應並生成鍺酸鹽[22]。當二氧化鍺與鍺金屬在高溫下反應時,會生成一氧化鍺[22]。二氧化鍺(及其相關的氧化物及鍺酸鹽)有一種很不尋常的特性,就是對可見光有着高折射率,但同時對紅外線隱形[30][31]。而鍺酸鉍則被用作閃鑠器(scintillator)[32]。
鍺還能與其它氧族元素生成二元化合物,例如二硫化物(GeS2)、二硒化物(GeSe2)、一硫化物(GeS)、一硒化物(GeSe)及碲化物(GeTe)[27]。把硫化氫氣體通過含Ge(IV)的強酸溶液時,會生成白色沉澱物,即二硫化鍺[27]。二硫化鍺能很好地溶於水、苛性鈉溶液及鹼金屬硫化物溶液中。但是,它不溶於酸性溶液,溫克勒就是憑藉這項性質才發現了鍺[33]。把二硫化鍺置於氫氣流中加熱,會生成一硫化鍺(GeS),它昇華後會形成一圈色暗但具金屬光澤的薄層,它可溶於苛性鈉溶液中。把一硫化鍺、鹼金屬碳酸鹽與硫一起加熱後,會生成一種鍺鹽化合物,叫硫代鍺酸鹽[34]。

鍺共有四種已知的四鹵化物。在正常狀況下四碘化鍺(GeI4)為固體,四氟化鍺(GeF4)為氣體,其餘兩種為揮發性液體。把鍺與氯一塊加熱,會得到一種沸點為83.1℃的無色發煙液體,即四氯化鍺[22]。鍺的所有四鹵化物都容易水解,生成帶結晶水的二氧化鍺[22]。四氯化鍺用於製備有機鍺化合物[27]。跟四鹵化物相反的是,全部四種已知的二鹵化物,皆為聚合固體[27]。另外已知的鹵化物還包括Ge2Cl6及GenCl2n+2[22]。還有一種奇特的化合物Ge6Cl16,其中含有類似新戊烷結構的Ge5Cl12[35]。
甲鍺烷(GeH4)是一種結構與甲烷相近的化合物。多鍺烷(即與烷烴相似的鍺化合物)的化學式為GenH2n+2,現時仍沒有發現n大於五的多鍺烷[27]。相對於矽烷,鍺烷的揮發性和活性都較低[27]。GeH4在液態氨中與鹼金屬反應後,會產生白色的MGeH3晶體,當中含有GeH3−陰離子[27]。含一、二、三個鹵素原子的氫鹵化鍺,皆為無色的活性液體[27]。

溫克勒於1887年合成出第一種有機鍺化合物(organogermanium compound);四氯化鍺與二乙基鋅反應生成四乙基鍺(Ge(C2H5)4)[9]。R4Ge型(其中R為烴基)的有機鍺烷,如四甲基鍺(Ge(CH3)4)及四乙基鍺,是由最便宜的鍺前驅物四氯化鍺及甲基親核劑反應而成。有機鍺氫化物,如異丁基鍺烷((CH3)2CHCH2GeH3)的危險性比較低,因此半導體工業會用液體的氫化物來取代氣體的甲鍺烷。已知鍺有不少活性中間物:鍺代自由基、鍺烯(與碳烯相近)和鍺炔(與卡賓相近)[36][37]。有機鍺化合物2-羧乙基鍺倍半氧烷(2-carboxyethylgermasesquioxane),於1970年被發現,曾經有一段時間被用作膳食補充劑,當時認為它可能對腫瘤有療效[38]。
同位素
[編輯]鍺共有五種天然存在的同位素:70Ge、72Ge、73Ge、74Ge和76Ge。當中,76Ge帶微弱的放射性,其衰變模式為雙β衰變,半衰期為1.58 × 1021年。74Ge是最常見的同位素,豐度約為36%。76Ge的自然豐度是最低的,約為7%[39]。當72Ge被α粒子轟擊時,會產生穩定的77Se,並在過程中釋放出高能量的電子[40]。因此,它與氡組合後可用作核電池[40]。
鍺最少有27種合成放射性同位素,各原子質量介乎58至89之間。當中最穩定的是68Ge,其衰變模式為電子捕獲,半衰期則為270.95 d。而當中最不穩定的則是60Ge,其半衰期為30 ms。儘管大部份鍺同位素的衰變模式皆為β衰變,但是也有例外。61Ge及64Ge的衰變模式為β+遲延質子發射(proton emission)[39],而84Ge至87Ge則有可能進行β-遲延中子發射[39]。
自然豐度
[編輯]鍺是由恆星核合成所創造的,主要是透過漸近巨星分支上恆星內的S-過程。S-過程是一種慢中子捕獲過程,發生於脈衝紅巨星中的輕元素[41]。在木星的大氣層中能探測到鍺[42],在一些遙遠的恆星中也能探測到鍺[43]。鍺在地球的地殼豐度約為1.6 ppm[44]。含鍺量可觀的礦石只有幾種,如硫銀鍺礦、灰鍺礦(briartitie)、硫鍺銅礦(germanite)及硫鍺鐵銅礦(renierite),而它們都沒有可供開採的礦床。儘管如此,開採這些礦石都不是為了它們所含的鍺[19][45]。一些鋅銅鉛礦體的含鍺量夠高,因此可以從它們最終的濃縮礦物中提取鍺[44]。
德國礦物學家威特·戈斯密(Victor Goldschmidt)在測量鍺礦床時,發現了一種奇特的濃縮過程,它使得一些煤礦層能擁有高含鍺量[46][47]。最高的含鍺量出現在英國諾森伯蘭郡哈特萊村(Hartley)的煤灰中,達1.6%[46][47]。內蒙古錫林浩特市附近的煤礦層含鍺量估計達1600公噸[44]。
製備
[編輯]
2007年鍺的年生產量約為100公噸[19]。現在,主要的方法是從鍺濃度達0.3%的閃鋅礦中提取鍺[48],它是當中的副產品,這種礦石最常出現於以沉積物為主體的大型Zn-Pb-Cu(-Ba)礦床,及以碳酸鹽為主體的Zn-Pb礦床[44]。儘管沒有全球鍺儲備量的確實數字,但是估計美國的儲備量約在500公噸左右[44]。在2007年,鍺的需求量有35%是由循環再造所滿足[44]。
鍺主要是由閃鋅礦中製取,而閃鋅礦是一種鋅礦石,但是也可以在銀、鉛及銅礦中找到鍺。若煤炭發電廠用的煤是從高鍺濃度的礦床來的話,那麼發電廠的飛灰(fly ash)也是鍺的一個來源。俄羅斯與中國都有在用這種鍺源[49]。俄羅斯的鍺礦床位於其遠東的庫頁島,而海參崴東北的煤礦也被用作鍺源[44]。中國的鍺礦床主要位於雲南省臨滄市的褐煤礦場,及內蒙古自治區錫林浩特市附近的煤礦,而它們都是開採中的鍺源[44]。
| 年份 | 價格 ($/kg)[50] |
|---|---|
| 1999 | 1,400 |
| 2000 | 1,250 |
| 2001 | 890 |
| 2002 | 620 |
| 2003 | 380 |
| 2004 | 600 |
| 2005 | 660 |
| 2006 | 880 |
| 2007 | 1,240 |
| 2008 | 1,490 |
| 2009 | 950 |
鍺的大部份濃縮礦物為硫化物;它們在空氣中加熱後會變成氧化物,這個過程叫焙燒(roasting):
- GeS2 + 3O2 → GeO2 + 2SO2
在這個過程中,部份鍺會進到所產生的灰塵中,而剩下的鍺則被轉化成鍺酸鹽,然後被硫酸淋溶,此時在爐渣中的鋅也被淋溶。在中和反應後,只有鋅留在溶液中,沉澱物中含有鍺及其他金屬。在用威爾茲冶鋅法(Waelz process)把沉澱物中的含鋅量減少後,而殘餘的威爾茲氧化物則接受第二次淋溶。此時從沉澱物中可得二氧化鍺,與氯氣或氯化氫反應後被轉化成四氯化鍺,由於它的沸點低,因此可用蒸餾法進行分離[49] :
- GeO2 + 4HCl → GeCl4 + 2H2O
- GeO2 + 2Cl2 → GeCl4 + O2
四氯化鍺會被水解成二氧化鍺,或用分餾法淨化後再被水解[49]。極純的GeO2適用於製造鍺玻璃。純二氧化鍺與氫反應後被還原成鍺,用這種還原方式所得的鍺,適用於紅外線光學或半導體工業:
- GeO2 + 4H2 → Ge + 2H2O
用於鋼鐵生產及其他工業過程的鍺,一般會用碳來還原[51]:
- GeO2 + C → Ge + CO2
應用
[編輯]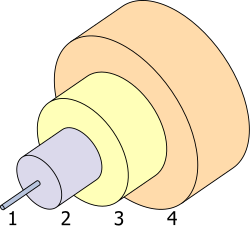
1. 核心 8 µm
2. 包層 125 µm
3. 緩衝層 250 µm
4. 護套 400 µm
鍺在2007年的估計全球終端應用為:光纖系統佔35%,紅外線光學(infrared optics)佔30%,聚合催化劑佔15%,及電子和太陽能發電也佔15%[19]。餘下的5%為其他應用,如磷光體(phosphor)、冶金及化學治療[19]。
光學
[編輯]二氧化鍺最值得注意的物理特性,就是它的高折射率,和低色散。因此特別適用於廣角鏡、顯微鏡和光纖核心[52][53]。它更取代了二氧化鈦,成為了二氧化矽光纖核心的摻雜物,這樣就不用再做後續熱處理,而這種處理會使光纖變得易碎[54]。在2002年末,光纖工業佔美國鍺用量的60%,但只佔全球用量不到10%[53]。鍺銻碲(GeSbTe)是一種相變合金,以其光學特性著稱,應用例子包括可重寫光碟[55]。
由於紅外線可以無損失的穿透鍺,因此它成了一種重要的紅外線光學材料,能很容易地被切割或打磨成鏡片及窗戶。它在紅外線光學中的一項重要應用,就是製作熱圖像照相機(thermal imaging camera)的鏡頭塗層。含鍺的這一種鏡頭用於波長為8至14微米的紅外線,這樣的紅外線可用於被動熱成像及熱點探測,因此能被應用於軍事、汽車夜視系統及消防[51]。這樣的鏡頭還能用於顯微鏡光譜儀,及其他需要極敏感紅外線探測的光學儀器[53]。鍺這種材料有着非常高的折射率(4.0),因此需要抗反射塗層。特別是類金剛石碳的抗反射塗層,這是一種特別堅硬的特殊塗層,其折射率為2.0,與鍺相若,而且會產生一層如鑽石堅硬的表面,足以面對戶外的各種嚴苛環境[56][57]。
電子工業
[編輯]電晶體主要由鍺和矽兩種高純度半導體製作,而鍺電晶體(簡稱鍺管)曾是電晶體時代早期(於40年代末開始)最重要的半導體產品,因為當時製作高純矽和製造矽管的製程都不夠成熟。鍺電晶體相比矽管,有B-E結壓降低(鍺管約0.2V,而矽管為0.6V左右)的優勢,但是熱穩定性較差,且響應速度的極限明顯不如矽管。鍺管的大規模應用大概持續到1970年左右,此後從發達國家開始逐漸淘汰,到1980年,幾乎在全世界範圍完全被矽管取代而退出電子工業[58]。然而,一些音響發燒友認為鍺管具有獨特的音色,相對於矽管的「冷硬」,鍺管溫暖醇厚的聲音特性被一些玩家稱為『低壓電子管』[59]因此一些生產於60年代的電聲設備和零件至今受到部分玩家的追捧,一些音樂用的踏板效果器還在用鍺電晶體,因為這種效果器能產生早期搖滾特有的「模糊」音質,當中最有名的是Dallas Arbiter公司所生產的Fuzz Face效果器[60]。
後來電子材料界又燃起了對鍺材料的興趣,不過已不局限於純鍺晶體。鍺化矽合金(一般稱為「矽鍺」)正急速地成為一種重要的半導體材料,用於高速集成電路。使用了Si-SiGe接面的電路,由於這種接面的特性,而比只用Si的要快得多[61]。在無線通訊(wireless communication)裝置中,鍺化矽正開始取代砷化鎵[19]。有着高速特性的SiGe晶片,可以用矽晶片工業傳統的生產技巧,並以低廉的成本生產[19]。
隨着能源成本的上漲,使得太陽能板的經濟價值有所提高,而這也是鍺的一大潛在應用[19]。鍺是太空用高效多結太陽能光電電池的晶圓基板。因為鍺的晶格常數(lattice constant)與砷化鎵相近,所以可以用鍺基板來製造砷化鎵太陽能電池[62]。火星探測漫遊者及數個人造衛星,都有使用鍺上三聯點砷化鎵電池[63]。
上鍺下絕緣體的基板,有望可以取代微型晶片中的矽[19]。其他電子應用還包括熒光燈的磷光體(phosphor)[23],及鍺基固態發光二極體[19]。
其他應用
[編輯]在生產聚對苯二甲酸乙二酯的過程中,二氧化鍺還可以用於催化聚合作用[64]。這樣生產出來的成品耀度很高,所以在日本銷售的PET瓶子都專門選用這一種聚酯[64]。然而,美國不把鍺用作聚合催化劑[19]。由於二氧化矽與二氧化鍺相近,所以氣相色譜柱中的固定相二氧化矽,可用二氧化鍺來取代[65]。
近年,在貴金屬合金中加入鍺是愈來愈多。例如,在英幣標準銀(sterling silver)(含銀量達95%以上的合金)中加入鍺,就能減少火紋(firescale)、增加抗鏽色性(tarnish)及增加對析出硬化(precipitation hardening)的反應。有一種抗鏽色的銀合金,商標名叫Argentium,其含鍺量需達1.2%[19]。
高純度鍺單晶探測器,能準確地探測出輻射的來源,因此可用於機場保安系統[66]。鍺亦被用於晶體單光儀(crystal monochromator),這台儀器能生成單晶中子散射(neutron scattering)及同步X射線繞射所需的線性束。在中子及高能X射線的應用,鍺的反射性比矽優勝[67]。高純度的鍺晶體還被用於伽瑪光譜學(gamma spectroscopy)和探尋暗物質的探測器中[68]。
鍺的一些化合物對哺乳類動物沒甚麼毒性,可是對某些細菌則有着相當的毒性[21]。就因為這項特性,所以這些鍺化合物可用作化學治療劑[69]。
對生物的影響
[編輯]一般認為鍺對動植物的健康並不重要。[70]由於鍺在礦石與碳質材料中是一種稀有元素,加上在商業應用中使用的量也不算多,所以它對自然並沒有甚麼影響[19]。
鍺化合物被用於白血病與肺癌的替代療法[16],但沒有醫學實證證實鍺的好處,甚至有證據表明它們有害[70]。美國食品藥品監督管理局的研究結論認為,當鍺被用作膳食補充劑時「有可能危害人體健康」[38]。
鍺本身不危險,但某些活潑的鍺化合物有毒。[71]例如四氯化鍺及甲鍺烷,分別為液體及氣體,能對眼睛、皮膚、肺部及喉嚨造成很大的刺激[72]。有些鍺化合物對哺乳動物的毒性低,但對細菌來說有毒。[21]
參見
[編輯]註釋
[編輯]- ^ 「鈤」亦為化學元素鐳的舊譯,因造成混淆而採用新譯。[73]
- ^ 在希臘語中,Argyrodite一詞有「含銀」的意思[74]。
- ^ 跟預測到新元素的存在一樣,數學家亞當斯與勒威耶,利用天王星軌道被拉出去的偏差,在1843年前後就預測到行星海王星的存在[75]。查理士(James Challis)於1846年8月開始搜尋第八顆行星[76],而加勒則於1846年9月23日正式觀測到它[77]。
- ^ 赫爾曼(R. Hermann)在1877年聲稱發現週期素中位於鉭下的元素,並以羅馬神話海王尼普頓命名為錼(Naptunium)[78][79]。但後來發現這種金屬只是元素鈮與鉭的合金[80]。很久以後,錼這個名字給了在週期表位於鈾下的合成元素,它是由核物理學家在1940年所發現[81] 。
參考資料
[編輯]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英語).
- ^ Magnetic susceptibility of the elements and inorganic compounds 互聯網檔案館的存檔,存檔日期2012-01-12., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ 3.0 3.1 3.2 3.3 Properties of Germanium. Ioffe Institute. (原始內容存檔於2012-01-25).
- ^ M. Agostini; et al. Final Results of GERDA on the Two-Neutrino Double-β Decay Half-Life of 76Ge. Physical Review Letters (American Physical Society (APS)). 2023-10-03, 131 (14). ISSN 0031-9007. doi:10.1103/physrevlett.131.142501.
- ^ Kaji, Masanori. D. I. Mendeleev's concept of chemical elements and The Principles of Chemistry (PDF). Bulletin for the History of Chemistry. 2002, 27 (1): 4–16 [2008-08-20]. (原始內容 (pdf)存檔於2008-12-17).
- ^ 6.0 6.1 6.2 Winkler, Clemens. Germanium, Ge, a New Nonmetal Element (English translation[失效連結]). Berichte der deutschen chemischen Gesellschaft. 1887, 19 (1): 210–211. doi:10.1002/cber.18860190156. (原始內容存檔於2012-10-13) (德語).
- ^ Germanium, a New Non-Metallic Element. The Manufacturer and Builder. 1887: 181 [2008-08-20]. (原始內容存檔於2008-12-19).
- ^ Winkler, Clemens. Mittheilungen über das Germanium. J. Prak. Chemie. 1886, 34: 177–229. doi:10.1002/prac.18860340122. (原始內容存檔於2012-11-03) (德語).
- ^ 9.0 9.1 9.2 9.3 Winkler, Clemens. Mittheilungen über des Germanium. Zweite Abhandlung. J. Prak. Chemie. 1887, 36: 177–209 [2008-08-20]. doi:10.1002/prac.18870360119. (原始內容存檔於2012-11-03) (德語).
- ^ Brunck, O. Obituary: Clemens Winkler. Berichte der deutschen chemischen Gesellschaft. 1886, 39 (4): 4491–4548. doi:10.1002/cber.190603904164 (德語).
- ^ de Boisbaudran, M. Lecoq. Sur le poids atomique du germanium. Comptes rendus. 1886, 103: 452 [2008-08-20]. (原始內容存檔於2013-06-20) (法語).
- ^ 12.0 12.1 Haller, E. E. Germanium: From Its Discovery to SiGe Devices (pdf). Department of Materials Science and Engineering, University of California, Berkeley, and Materials Sciences Division, Lawrence Berkeley National Laboratory, Berkeley,. [2008-08-22]. (原始內容存檔 (PDF)於2019-07-10).
- ^ W. K. Germanium for Electronic Devices. NY Times. 1953 [2008-08-22]. (原始內容存檔於2013-06-13).
- ^ 1941 - Semiconductor diode rectifiers serve in WW II. Computer History Museum. [2008-08-22]. (原始內容存檔於2008-09-24).
- ^ SiGe History. University of Cambridge. [2008-08-22]. (原始內容存檔於2008-08-05).
- ^ 16.0 16.1 16.2 16.3 16.4 16.5 Halford, Bethany. Germanium. Chemical & Engineering News (American Chemical Society). 2003 [2008-08-22]. (原始內容存檔於2008-05-13).
- ^ Bardeen, J.; Brattain, W. H. The Transistor, A Semi-Conductor Triode. Physical Reviews. 1948, 74: 230–231. doi:10.1103/PhysRev.74.230.
- ^ Electronics History 4 - Transistors. National Academy of Engineering. [2008-08-22]. (原始內容存檔於2007-10-20).
- ^ 19.00 19.01 19.02 19.03 19.04 19.05 19.06 19.07 19.08 19.09 19.10 19.11 19.12 19.13 19.14 U.S. Geological Survey. Germanium—Statistics and Information. U.S. Geological Survey, Mineral Commodity Summaries. 2008 [2008-08-28]. (原始內容存檔於2008-09-16).
Select 2008
- ^ Teal, Gordon K. Single Crystals of Germanium and Silicon-Basic to the Transistor and Integrated Circuit (PDF). IEEE Transactions on Electron Devices. July 1976, ED–23 (7): 621–639. doi:10.1109/T-ED.1976.18464.[失效連結]
- ^ 21.0 21.1 21.2 Emsley, John. Nature's Building Blocks. Oxford: Oxford University Press. 2001: 506–510. ISBN 0-19-850341-5. 引用錯誤:帶有name屬性「nbb」的
<ref>標籤用不同內容定義了多次 - ^ 22.0 22.1 22.2 22.3 22.4 22.5 22.6 22.7 Holleman, A. F.; Wiberg, E.; Wiberg, N. Lehrbuch der Anorganischen Chemie 102. de Gruyter. 2007. ISBN 978-3-11-017770-1. OCLC 145623740.
- ^ 23.0 23.1 Germanium. Los Alamos National Laboratory. [2008-08-28]. (原始內容存檔於2008-06-10).
- ^ Chardin, B. Dark Matter: Direct Detection. Binetruy, B. (編). The Primordial Universe: 28 June - 23 July 1999. Springer. 2001: 308. ISBN 3540410465.
- ^ 25.0 25.1 Lévy, F.; Sheikin, I.; Grenier, B.; Huxley, Ad. Magnetic field-induced superconductivity in the ferromagnet URhGe. Science. 2005-08, 309 (5739): 1343–1346. PMID 16123293. doi:10.1126/science.1115498.
- ^ Tabet, N. KRXPS study of the oxidation of Ge(001) surface. Applied Surface Science. 1998, 134: 275. doi:10.1016/S0169-4332(98)00251-7.
- ^ 27.00 27.01 27.02 27.03 27.04 27.05 27.06 27.07 27.08 27.09 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Tabet, N. XPS study of the growth kinetics of thin films obtained by thermal oxidation of germanium substrates. Journal of Electron Spectroscopy and Related Phenomena. 1999,. 101-103: 233. doi:10.1016/S0368-2048(98)00451-4.
- ^ Xu, Li; Sevov, Slavi C. Oxidative Coupling of Deltahedral [Ge9]4− Zintl Ions. J. Am. Chem. Soc. 1999, 121 (39): 9245–9246. doi:10.1021/ja992269s.
- ^ Bayya, Shyam S.; Sanghera, Jasbinder S.; Aggarwal, Ishwar D.; Wojcik, Joshua A. Infrared Transparent Germanate Glass-Ceramics. Journal of the American Ceramic Society. 2002, 85 (12): 3114–3116.
- ^ Drugoveiko, O. P. Infrared reflectance and transmission spectra of germanium dioxide and its hydrolysis products. Journal of Applied Spectroscopy. 1975, 22: 191. doi:10.1007/BF00614256.
- ^ Lightstone, A. W.; McIntyre, R. J.; Lecomte, R.; Schmitt, D. A Bismuth Germanate-Avalanche Photodiode Module Designed for Use in High Resolution Positron Emission Tomography. IEEE Transactions on Nuclear Science. 1986, 33 (1): 456–459. doi:10.1109/TNS.1986.4337142.
- ^ Johnson, Otto H. Germanium and its Inorganic Compounds. Chem. Rev. 1952, 3: 431 – 431. doi:10.1021/cr60160a002.
- ^ Fröba, Michael. First synthesis of mesostructured thiogermanates. Chemical Communications. 1997: 1729. doi:10.1039/a703634e.
- ^ Beattie, I.R.; Jones, P.J.; Reid, G.; Webster, M. The Crystal Structure and Raman Spectrum of Ge5Cl12·GeCl4 and the Vibrational Spectrum of Ge2Cl6. Inorg. Chem. 1998, 37 (23): 6032–6034. doi:10.1021/ic9807341.
- ^ Satge, Jacques. Reactive intermediates in organogermanium chemistry. Pure & Appl. Chem. 1984, 56 (1): 137–150. doi:10.1351/pac198456010137.
- ^ Quane, Denis; Bottei, Rudolph S. Organogermanium Chemistry. Chemical Reviews. 1963, 63 (4): 403–442. doi:10.1021/cr60224a004.
- ^ 38.0 38.1 Tao, S. H.; Bolger, P. M. Hazard Assessment of Germanium Supplements. Regulatory Toxicology and Pharmacology. June 1997, 25 (3): 211–219. doi:10.1006/rtph.1997.1098.
- ^ 39.0 39.1 39.2 Audi, G. Nubase2003 Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center). 2003, 729: 3–128. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ 40.0 40.1 Alpha Fusion Electrical Energy Valve (PDF). Nu Energy Research Institute. [2008-09-10]. (原始內容 (pdf)存檔於2008-10-01).
- ^ Sterling, N. C.; Dinerstein, Harriet L.; Bowers, Charles W. Discovery of Enhanced Germanium Abundances in Planetary Nebulae with the Far Ultraviolet Spectroscopic Explorer. The Astrophysical Journal Letters. 2002, 578: L55–L58. doi:10.1086/344473.
- ^ Kunde, V.; Hanel, R.; Maguire, W.; Gautier, D.; Baluteau, J. P.; Marten, A.; Chedin, A.; Husson, N.; Scott, N. The tropospheric gas composition of Jupiter's north equatorial belt /NH3, PH3, CH3D, GeH4, H2O/ and the Jovian D/H isotopic ratio. Astrophysical J. 1982, 263: 443–467. doi:10.1086/160516.
- ^ Cowan, John. Astronomy: Elements of surprise. Nature. 2003-05-01, 423 (29): 29. doi:10.1038/423029a.
- ^ 44.0 44.1 44.2 44.3 44.4 44.5 44.6 44.7 Höll, R.; Kling, M.; Schroll, E. Metallogenesis of germanium—A review. Ore Geology Reviews. 2007, 30 (3–4): 145–180. doi:10.1016/j.oregeorev.2005.07.034.
- ^ Lifton, Jack. Byproducts II: Another Germanium Rush?. Resource Investor.com. 2007-04-26 [2008-09-09]. (原始內容存檔於2007-06-12).
- ^ 46.0 46.1 Goldschmidt, V. M. Ueber das Vorkommen des Germaniums in Steinkohlen und Steinkohlenprodukten. Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse. 1930: 141–167 [2012-10-16]. (原始內容存檔於2008-12-01).
- ^ 47.0 47.1 Goldschmidt, V. M.; Peters, Cl. Zur Geochemie des Germaniums. Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse. 1933: 141–167 [2012-10-16]. (原始內容存檔於2008-12-01).
- ^ Bernstein, L. Germanium geochemistry and mineralogy. Geochimica et Cosmochimica Acta. 1985, 49: 2409. doi:10.1016/0016-7037(85)90241-8.
- ^ 49.0 49.1 49.2 Naumov, A. V. World market of germanium and its prospects. Russian Journal of Non-Ferrous Metals. 2007, 48 (4): 265–272. doi:10.3103/S1067821207040049.
- ^ R.N. Soar. USGS Minerals Information. U.S. Geological Survey Mineral Commodity Summaries. 1977. 2003-01, 2004-01, 2005-01, 2006-01, 2007-01, January 2010 [2013-04-22]. ISBN 978-0-85934-039-7. OCLC 16437701. (原始內容存檔於2013-05-07).
- ^ 51.0 51.1 Moskalyk, R. R. Review of germanium processing worldwide. Minerals Engineering. 2004, 17: 393–402. doi:10.1016/j.mineng.2003.11.014.
- ^ Rieke, G.H. Infrared Detector Arrays for Astronomy. Annu. Rev. Astro. Astrophys. 2007, 45: 77. doi:10.1146/annurev.astro.44.051905.092436.
- ^ 53.0 53.1 53.2 Brown, Jr., Robert D. Germanium (pdf). U.S. Geological Survey. 2000 [2008-09-22]. (原始內容存檔 (PDF)於2011-08-22).
- ^ Chapter III: Optical Fiber For Communications. Stanford Research Institute. [2008-08-22]. (原始內容存檔於2006-06-15).
- ^ Understanding Recordable & Rewritable DVD First Edition (PDF). Optical Storage Technology Association (OSTA). [2008-09-22]. (原始內容 (pdf)存檔於2009-04-19).
- ^ Lettington, Alan H. Applications of diamond-like carbon thin films. Carbon. 1998, 36 (5–6): 555–560. doi:10.1016/S0008-6223(98)00062-1.
- ^ Gardos, Michael N.; Soriano, Bonnie L.; Propst, Steven H. Study on correlating rain erosion resistance with sliding abrasion resistance of DLC on germanium. Proc. SPIE,. 1990, 1325 (Mechanical Properties): 99. doi:10.1117/12.22449.
- ^ 存档副本 (PDF). [2016-06-02]. (原始內容 (PDF)存檔於2016-08-07).
- ^ 存档副本. [2016-06-02]. (原始內容存檔於2017-03-05).
- ^ Szweda, Roy. Germanium phoenix. III-Vs Review. 2005, 18 (7): 55. doi:10.1016/S0961-1290(05)71310-7.
- ^ Washio, K. SiGe HBT and BiCMOS technologies for optical transmission and wireless communication systems. IEEE Transactions on Electron Devices. 2003, 50: 656. doi:10.1109/TED.2003.810484.
- ^ Bailey, Sheila G. Space and terrestrial photovoltaics: synergy and diversity. Progress in Photovoltaics Research and Applications. 2002, 10: 399. doi:10.1002/pip.446.
- ^ Crisp, D.; Pathare, A.; Ewell, R. C. The performance of gallium arsenide/germanium solar cells at the Martian surface. Progress in Photovoltaics Research and Applications. 2004, 54 (2): 83–101. doi:10.1016/S0094-5765(02)00287-4.
- ^ 64.0 64.1 Thiele, Ulrich K. The Current Status of Catalysis and Catalyst Development for the Industrial Process of Poly(ethylene terephthalate) Polycondensation. International Journal of Polymeric Materials. 2001, 50 (3): 387 – 394. doi:10.1080/00914030108035115.
- ^ Fang, Li; Kulkarni, Sameer; Alhooshani, Khalid; Malik, Abdul. Germania-Based, Sol-Gel Hybrid Organic-Inorganic Coatings for Capillary Microextraction and Gas Chromatography. Anal. Chem. 2007, 79 (24): 9441–9451. doi:10.1021/ac071056f.
- ^ Keyser, Ronald; Twomey, Timothy; Upp, Daniel. Performance of Light-Weight, Battery-Operated, High Purity Germanium Detectors for Field Use (PDF). Oak Ridge Technical Enterprise Corporation (ORTEC). [2008-09-06]. (原始內容 (pdf)存檔於2007-10-26).
- ^ Ahmed, F. U. Optimization of Germanium for Neutron Diffractometers. International Journal of Modern Physics E. 1996, 5: 131. doi:10.1142/S0218301396000062.
- ^ Diehl, R. Astrophysical constraints from gamma-ray spectroscopy. Nuclear Physics A. 2006, 777: 70. doi:10.1016/j.nuclphysa.2005.02.155.
- ^ Slavik, Milan; Blanc, Oscar; Davis, Joan. Spirogermanium: A new investigational drug of novel structure and lack of bone marrow toxicity. Investigational New Drugs. 1983, 1 (3): 225–234. doi:10.1007/BF00208894.
- ^ 70.0 70.1 Germanium. American Cancer Society. [2008-08-31]. (原始內容存檔於2008-06-10).
- ^ Brown, Robert D. Jr. Commodity Survey:Germanium (PDF) (報告). US Geological Surveys. [2008-09-09]. (原始內容存檔 (PDF)於2018-03-04).
- ^ Gerber, G.B.; Léonard, A. Mutagenicity, carcinogenicity and teratogenicity of germanium compounds. Regulatory Toxicology and Pharmacology. 1997, 387: 141–146. doi:10.1016/S1383-5742(97)00034-3.
- ^ 鈤. 教育部《異體字字典》. (原始內容存檔於2015-06-20).
- ^ Argyrodite—Ag
8GeS
6 (pdf) (報告). Mineral Data Publishing. [2008-09-01]. (原始內容存檔 (PDF)於2008-12-19). - ^ Adams, J. C. Explanation of the observed irregularities in the motion of Uranus, on the hypothesis of disturbance by a more distant planet. Monthly Notices of the Royal Astronomical Society (Blackwell Publishing). November 13, 1846, 7: 149 [2008-02-18]. (原始內容存檔於2016-01-10).
- ^ Challis, Rev. J. Account of observations at the Cambridge observatory for detecting the planet exterior to Uranus. Monthly Notices of the Royal Astronomical Society (Blackwell Publishing). November 13, 1846, 7: 145–149 [2008-02-18]. (原始內容存檔於2016-01-10).
- ^ Galle, J. G. Account of the discovery of the planet of Le Verrier at Berlin. Monthly Notices of the Royal Astronomical Society. 13 November 1846, 7: 153. Bibcode:1846MNRAS...7..153G.
- ^ Sears, Robert. Scientific Miscellany. The Galaxy (Columbus, O[hio]: Siebert & Lilley). 1877-07, 24 (1): 131. ISBN 0665501668. OCLC 16890343.
- ^ Editor's Scientific Record. Harper's new monthly magazine. 1877-06, 55 (325): 152–153 [2012-10-09]. (原始內容存檔於2012-05-26).
- ^ van der Krogt, Peter. Elementymology & Elements Multidict: Niobium. [2008-08-20]. (原始內容存檔於2008-09-22).
- ^ Westgren, A. The Nobel Prize in Chemistry 1951: presentation speech. Nobel Lectures, Chemistry 1942-1962. Elsevier. 1964. (原始內容存檔於2008-12-10).
外部連結
[編輯]- 元素鍺在洛斯阿拉莫斯國家實驗室的介紹(英文)
- EnvironmentalChemistry.com —— 鍺(英文)
- 元素鍺在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素鍺在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 鍺(英文)



