鎘
鎘在大多數鋅礦中作為次要成分出現,並且是生產鋅的副產物。鎘和鋅均可用作電池材料。鎘可製作鎳鎘電池,其被用於塑膠製造和金屬電鍍、生產顏料、油漆、染料、印刷油墨等某些黃色的顏料、製作車胎、某些發光電子組件和核子反應爐原件。[2][3] 鎘長期用作鋼上的耐腐蝕鍍層,鎘化合物則是用作紅色、橙色和黃色顏料,幫玻璃上色著色,以及穩定塑料。鎘的使用正普遍減少,因為它含有毒性(它被特別列入歐洲有害物質限制[4]),且鎳鎘電池已被鎳氫電池和鋰離子電池取代。其中之一的少數新用途是碲化鎘太陽能板。
雖然鎘在較高等生物體中並無已知的生物功能,但在海洋矽藻中已發現了鎘依賴性碳酸酐酶。
性質
[編輯]物理性質
[編輯]鎘是一種柔軟、有延展性、銀白色的二價金屬。 它在許多方面與鋅相似,但會形成配合物。[5]與大多數金屬不同,鎘具有耐腐蝕性,可作為其他金屬的保護鍍層。塊狀的金屬鎘不溶於水[6]、不易燃;然而,粉末形式的鎘可能會燃燒並釋放有毒煙霧。[7]
化學性質
[編輯]雖然鎘通常具有+2價的氧化態,它也存在+1價的狀態。鎘及其同族元素有時不被認為是過渡金屬,因為它們在元素態或常見氧化態下不具有未填滿之d或f軌域。[8]鎘在空氣中燃燒會形成棕色的非晶體氧化鎘。該化合物的晶體呈深紅色,並會隨著加熱而改變顏色,此性質類似於氧化鋅。鎘溶於鹽酸、硫酸和硝酸,分別形成氯化鎘、硫酸鎘以及硝酸鎘。若要產生氧化態+1價的鎘,可將鎘溶解在氯化鎘和氯化鋁的混合物中,會形成與Hg22+相似的Cd22+陽離子。[5]
- Cd + CdCl2 + 2 AlCl3 → Cd2(AlCl4)2
鎘分別與核鹼基、氨基酸及維生素分子所形成之錯合物結構已被確定。[9]
同位素
[編輯]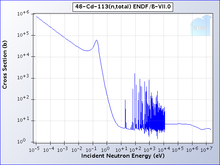
自然界中的鎘由8種同位素組成。其中兩種具有放射性,三種被預測會衰變不過尚未在實驗室被觀察到。兩種自然界中具有放射性的同位素分別為113Cd(β衰變,半衰期為7.7×1015年)和116Cd(雙β衰變,半衰期為2.9 × 1019年)。另外三種同位素為 106Cd、108Cd(都是雙電子捕獲)和 114Cd(雙β衰變),對於這三種只知道半衰期的下限。至少有三種同位素——110Cd、111Cd和112Cd是穩定的。人造同位素的部分,半衰期最長的是462.6天的109Cd和53.46小時的115Cd,其餘具放射性的同位素的半衰期都不到2.5小時,大多數甚至都不到5分鐘。鎘有8個已知的同核異構體,其中最穩定的是113mCd(t1⁄2 = 14.1 年)、115mCd(t1⁄2 = 44.6 天)和 117mCd(t1⁄2 = 3.36 小時)。[10]
鎘的已知同位素的原子量範圍從94.950 u(95Cd)到131.946 u(132Cd)都有。原子量小於112 u的同位素主要的衰變模式為電子捕獲,而主要的衰變產物是銀,但較重的同位素主要透過β衰變衰變成銦。[10]
鎘-113對於吸收中子有高選擇性。當中子的能量低於鎘的截止能時,中子將有很大機率被吸收,而高於鎘的截止能的中子將會穿透。鎘的截止能大概是0.5eV,低於這個能量的中子就是慢中子。[11]
鎘在一些低或中等質量的星體(0.6~10倍的太陽質量)裡透過s-過程產生數千年。在此過程中,一顆銀原子捕獲一顆中子,然後進行β衰變。[12]
來源
[編輯]約有一千萬分之一(0.1 ppm)的地殼是由鎘所構成。比起構成地殼約百萬分之六十五(65 ppm)的鋅,鎘稀少許多。目前沒有已知礦物顯著含鎘。唯一的重要含鎘礦物,硫鎘礦,幾乎總是和閃鋅礦一起出現,因為它們在地質化學上的相似性,也幾乎沒有地質過程會分離它們。因此,鎘通常是採礦、冶煉和提純含硫鋅礦(較小程度上,鉛礦和銅礦)的副產品。少量的鎘,約占總產量的十分之一,多數來自廢鐵和廢鋼的回收。美國在1907年開始生產,但在一次大戰後開始大量使用。
在開採來製作磷酸鹽肥料的岩石中含有不同量的鎘,導致肥料中的鎘濃度高達每公斤300毫克,也導致農業土壤中的高鎘含量。煤炭中可能含有大量的鎘,多數隨著燃燒成為煙塵。土壤中的鎘可以被一些農作物吸收,例如稻米。中華人民共和國農業部在2002年檢測到有百分之28的稻米取樣含有超過法律規範的限制的鉛,而百分之10的稻米取樣含有超過法律規範的限制的鎘。一些植物,例如柳樹和楊屬植物,被發現可以清除土壤中的鉛和鎘汙染。
生產
[編輯]根據英國地質調查局在2001年的報告,中國是鎘的最大量生產者,生產了世界產量的六分之一,緊接在後的是南韓和日本。
鎘是一個含鋅礦物中常見的雜質,而通常會在製造鋅的過程被分離。有些由含硫鋅礦得到的鋅礦高達百分之1.4的鎘。在1970年代,出產一噸含有的鋅中含有6.5磅的鎘。因為氧氣的存在,硫化鋅礦物會被氧化成為氧化物。鋅金屬可以藉由碳來冶煉該氧化物而產生,或藉由該氧化物在硫酸中的電鍍。藉由真空蒸餾法,可以在冶煉鋅的過程中隔離鎘雜質,而硫化鎘會在電解液中沉澱。
歷史
[編輯]1817年,化學家卡爾·塞繆爾·萊貝雷希特·赫爾曼、弗里德里希·施特羅邁爾和羅洛夫幾乎同時發現了鎘元素。[13]
鎘污染
[編輯]鎘對健康有不良的影響,被列為可致癌物。
1930-1960年代,日本富山縣神通川流域部分被鎘污染,發生痛痛病,事緣煉鋅廠排放的含鎘廢水污染了周圍的耕地和水源。
廣州中山大學生物科技學院聯同香港浸會大學生物系在2006年3至4月期間,抽查化驗中港兩地市面出售的楊桃,51%鎘含量屬嚴重超標。[14]
-
可由電解氯化鎘水溶液製取鎘金屬
-
電解法製出的鎘
各地對鎘安全標準
[編輯]台灣
[編輯]根據《中華民國國家標準污水綜合排放標準[15]》,鎘屬於第一類污染物,其最高允許排放濃度為0.1mg/L。[16]
歐盟
[編輯]美國
[編輯]美國環境保護署限制排入湖、河、棄置場和農田的鎘量並禁止殺蟲劑中含有鎘。美國環境保護署允許飲用水含有10ppb的鎘,並打算把限制減到5ppb。美國食品和藥物管理局規定食用色素的含鎘量為不得多於15ppm。美國職業安全衛生署規定工作環境空氣中鎘含量在煙霧為100微克/立方公尺,在鎘塵為200微克/ 立方公尺。美國職業安全衛生署計劃將空氣中所有鎘化合物含量限制在1到5微克/ 立方公尺美國國家職業安全和衛生研究所希望讓工人盡量少呼吸到鎘以防止肺癌[18]。
參考資料
[編輯]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英語).
- ^ 存档副本. [2007-09-22]. (原始內容存檔於2013-11-27).
- ^ 存档副本 (PDF). [2007-09-22]. (原始內容 (PDF)存檔於2009-04-19).
- ^ Morrow, H. Cadmium and Cadmium Alloys. Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons. 2010: 1–36. ISBN 978-0-471-23896-6. doi:10.1002/0471238961.0301041303011818.a01.pub3.
- ^ 5.0 5.1 Holleman, A. F.; Wiberg, E.; Wiberg, Nils. Cadmium. Lehrbuch der Anorganischen Chemie, 91–100. Walter de Gruyter. 1985: 1056–1057. ISBN 978-3-11-007511-3 (德語).
- ^ Cadmium 3.2.6 Solubility. PubChem. [25 November 2021]. (原始內容存檔於2022-07-09).
- ^ Case Studies in Environmental Medicine (CSEM) Cadmium. Agency for Toxic Substances and Disease Registry. [30 May 2011]. (原始內容存檔於6 June 2011).
- ^ Cotton, F. A. Survey of Transition-Metal Chemistry. Advanced Inorganic Chemistry 6th. John Wiley and Sons. 1999: 633. ISBN 978-0-471-19957-1.
- ^ Carballo, Rosa; Castiñeras, Alfonso; Domínguez-Martin, Alicia; García-Santos, Isabel; Niclós-Guttiérrez, Juan. Chapter 7. Solid state structures of cadmium complexes with relevance to biological systems. Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (編). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences 11. Springer. 2013: 145–189. ISBN 978-94-007-5178-1. PMID 23430774. doi:10.1007/978-94-007-5179-8_7. hdl:11093/232.
- ^ 10.0 10.1 Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik. The NUBASE evaluation of nuclear and decay properties. Nuclear Physics A. 2003, 729: 3–128. Bibcode:2003NuPhA.729....3A. ISSN 0375-9474. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ Knoll, G. F. Radiation Detection and Measurement. Wiley. 2000: 505. ISBN 978-0-471-07338-3.
- ^ Padmanabhan, T. Stellar Nucleosynthesis. Theoretical Astrophysics, Volume II: Stars and Stellar Systems. Cambridge University Press. 2001: 230–236 [2022-03-30]. ISBN 978-0-521-56631-5. (原始內容存檔於2022-05-21).
- ^ Cadmium. Elementymology & Elements Multidict. [2018-12-03]. (原始內容存檔於2010-01-23).
- ^ 存档副本. [2007-09-22]. (原始內容存檔於2014-02-28).
- ^ /, /. 中华人民共和国国家标准 污水综合排放标准 (中華民國強制性國家標準). 國家技術監督局. 1996-10-04 [2017-08-18]. (原始內容存檔於2021-05-07).
- ^ GB 8978-1996 污水综合排放标准. [2012-03-09]. (原始內容存檔於2021-05-07).
- ^ http://www.environment-agency.gov.uk/business/444255/446867/255244/substances/29/?any_all=&choose_order=&exactphrase=&lang=_e®ion=&searchfor=unece&subject=&theme=&withoutwords=[永久失效連結]
- ^ 存档副本. [2007-09-22]. (原始內容存檔於2019-06-30).
外部連結
[編輯]- 元素鎘在洛斯阿拉莫斯國家實驗室的介紹(英文)
- EnvironmentalChemistry.com —— 鎘(英文)
- 元素鎘在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素鎘在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 鎘(英文)