[4+4]環加成反應
[4+4]環加成反應是一種光化學環加成反應,指兩個含有四原子共軛體系的分子經光促條件形成一個新的含八元環的分子的反應,可用於八元環及更大環體系的構建。此類反應首先發現於蒽的光二聚化反應中。受副產物競爭、正向反應熵不利等因素影響,該類反應應用不廣,但因其簡便地構成了大環,仍具有一定應用價值。
簡介
[編輯]1936年,路易斯·弗雷德里克·菲澤在蒽的結構表徵研究中首次觀測到了蒽的光二聚化反應,即[4+4]環加成反應。[1]蒽的光二聚化反應至今仍是最可靠的[4+4]環加成反應之一,並且是其他相關研究的基石。[2]
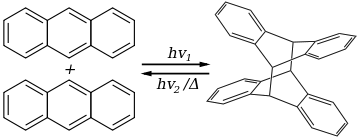
其他多環芳香族化合物也會經歷類似蒽的環加成反應,例如吖啶。自然界中,歷經該反應得到的具有生物活性的天然產物有截短側耳素、卡爾曼醇、腎上腺素和龍膽酚等。通過[4+4]環加成反應建立環辛烷體系的幾個引人注目的優點在於:可由兩個相對簡單的四碳片段聚合成八元環、通過形成兩個新的碳碳鍵連接分子,以及最多可同時引入四個新的立體中心。[3]
反應機理和立體化學
[編輯]反應機理
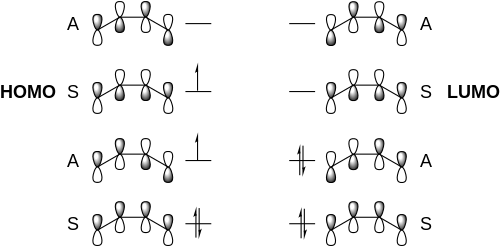
[編輯][4+4]環加成反應在基態下反應禁阻,而在激發態下,正反應通常熵不利,導致了產率問題。[4][4+4]光環加成反應首先從一個1,3-二烯體系的光激發開始。一分子激發態共軛二烯中最高占據分子軌道(HOMO)的軌道對稱性與另一分子基態二烯中最低未占據分子軌道(LUMO)的軌道對稱性相同,因此它們能形成激基複合物。隨後該激基複合物衰變閉環形成了環辛烷結構。
立體化學
[編輯][4+4]環加成反應中的立體化學控制並不常見,但確實存在,如某些交聯技術可以成功實現Enol-exo立體選擇性。[5]

除個別特例外,通過使用現有立體中心來控制形成橋頭碳原子的立體構型基本上無法實現。[6]
有機合成應用
[編輯][4+4]環加成反應常和[2+2]環加成反應競爭,因此[4+4]環加成的實際應用很少。但若當該反應有一定產率時,此法可用於一步構建具有複雜立體中心的八元環結構,如2000年Yong-gyun Lee、Kevin F. McGee等擬議的對紫杉醇的合成[7]與對岩藻球菌素家族分子的合成[8]。另外,儘管該反應首先形成了稠環,但隨後可裂解形成大環。[9]
![通過[4+4]環加成反應合成紫杉醇中八元環的方案](http://upload.wikimedia.org/wikipedia/commons/thumb/c/cf/Key_step_building_the_BC_rings_of_Taxol_in_a_proposed_synthesis.svg/720px-Key_step_building_the_BC_rings_of_Taxol_in_a_proposed_synthesis.svg.png)
在紫杉醇八元環部分合成中,通過[4+4]環加成反應進行環構架建立只需利用一個相對線性且簡單的2-吡啶酮衍生物,將其摺疊成環便可得到所需的稠合環,產物C3、C8和C15(相較紫杉醇)立體構型符合預期,並且環上兩個雙鍵可接受反式加成。預期該產物內酰胺環的開環與進一步官能團化將產生紫杉酚。[7]

同樣,使用該反應可以快速構建具有5-8-5環系統的岩藻球菌素家族分子。儘管該反應形成反式異構體的立體選擇性高,使其不適合目標分子的後續合成,但其容易產生四個三級手性中心的特性仍引人關注。[8]
![十一元[5+8]稠環的構建](http://upload.wikimedia.org/wikipedia/commons/thumb/3/38/Eleven-membered_ring_form_4%2B4_photocycloaddition.svg/720px-Eleven-membered_ring_form_4%2B4_photocycloaddition.svg.png)
[4+4]環加成反應並不局限於構建八元環。只要通過連接環網,然後斷開並環共用的共價鍵,就可以實現預置了立體中心的宏環的合成。
局限性
[編輯][4+4]環加成反應不可避免地帶有[2 + 2]環加成反應的副產物。但由於反應可逆,可以通過熱力學控制形成較穩定的產物。[10]
![[4+4]環加成反應副反應的發生](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7d/Cisfused5-8ringconstruction.svg/500px-Cisfused5-8ringconstruction.svg.png)
參見
[編輯]參考文獻
[編輯]- ^ Fieser, Louis F.; Lothrop, Warren C. The Structure of Anthracene. J. Am. Chem. Soc. 1936, 58: 749–753. doi:10.1021/ja01296a016.
- ^ Heiko, I.; Luo, J. The reversible [4+4] photocycloaddition of acridizinium derivatives. J. Photochem. Photobiol., A. 2008, 200: 3–9. doi:10.1016/j.jphotochem.2008.04.008.
- ^ Zhu, M.; Qiu, Z.; Hiel, G.; Sieburth, S. Photocycloaddition of Four-Carbon-Tethered Pyridones. Intramolecular Hydrogen Bonding and Facilitated Amide Hydrolysis by a Proximal Secondary Alcohol.. J. Org. Chem. 2002, 67: 3487–3493. doi:10.1021/jo025565n.
- ^ Wender, P.; Smith, T. Transition Metal-Catalyzed Intramolecular [4+2] Cycloadditions: Mechanistic and Synthetic Investigations. Tetrahedron. 1998, 54: 1255–1275. doi:10.1016/S0040-4020(97)10223-X.
- ^ Lei, L.; Benderb, J.; West F. G. Diastereocontrol in [4+4]-photocycloadditions of pyran-2-ones: effect of ring substituents and chiral ketal. Tetrahedron Lett. 2009, 50: 1188–1192. doi:10.1016/j.tetlet.2008.12.117.
- ^ Song, D.; McDonald, R.; West, F. G. Diastereoselective [4+4]-photocycloaddition reactions of pyran-2-ones: rapid access to functionalized 5-8-5 skeletons. Org. Lett. 2006, 8: 4075–4078. doi:10.1021/ol061576h.
- ^ 7.0 7.1 Lee, Y.-G.; McGee, K. F.; Chen, J.; Rucando, D.; Sieburth, S. McN. A [4+4] 2-Pyridone Approach to Taxol. 3. Stereocontrol during Elaboration of the Cyclooctane. J. Org. Chem. 2000, 65: 6676–6681. doi:10.1021/jo005532c.
- ^ 8.0 8.1 McGee, K. F.; Al-Tel, T. H.; Sieburth, S. McN. Fusicoccin Synthesis by Intramolecular [4+4] Photocycloaddition of 2-Pyridones: Stereocontrol of the Cycloaddition and Elaboration of the Pentacyclic Product. Synthesis. 2001, 112: 1185–1196. doi:10.1055/s-2001-15066.
- ^ Sieburth, S. McN.; Al-Tel, T. H.; Rucando, D. Beyond the medium ring: A [4+4] Cycloaddition/Fragmentation Synthesis of Eleven-membered Rings. Tetrahedron Lett. 1997, 38: 8433–8434. doi:10.1016/S0040-4039(97)10272-6.
- ^ Sieburth, S. McN.; Cunard, N. T. The [4+4] cycloaddition and its strategic application in natural product synthesis. Tetrahedron. 1996, 52: 6251–6282. doi:10.1016/0040-4020(95)01077-7.
