[4+4]環加成反應
[4+4]环加成反应是一种光化学环加成反应,指两个含有四原子共轭体系的分子经光促条件形成一个新的含八元环的分子的反应,可用于八元环及更大环体系的构建。此类反应首先发现于蒽的光二聚化反应中。受副产物竞争、正向反应熵不利等因素影响,该类反应应用不广,但因其简便地构成了大环,仍具有一定应用价值。
简介
[编辑]1936年,路易斯·弗雷德里克·菲泽在蒽的结构表征研究中首次观测到了蒽的光二聚化反应,即[4+4]环加成反应。[1]蒽的光二聚化反应至今仍是最可靠的[4+4]环加成反应之一,并且是其他相关研究的基石。[2]

其他多环芳香族化合物也会经历类似蒽的环加成反应,例如吖啶。自然界中,历经该反应得到的具有生物活性的天然产物有截短侧耳素、卡尔曼醇、肾上腺素和龙胆酚等。通过[4+4]环加成反应建立环辛烷体系的几个引人注目的优点在于:可由两个相对简单的四碳片段聚合成八元环、通过形成两个新的碳碳键连接分子,以及最多可同时引入四个新的立体中心。[3]
反应机理和立体化学
[编辑]反应机理
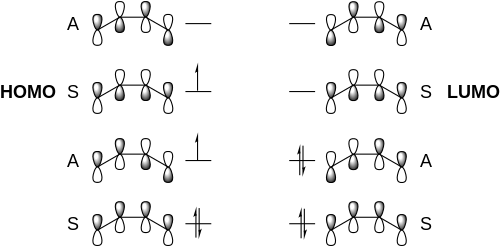
[编辑][4+4]环加成反应在基态下反应禁阻,而在激发态下,正反应通常熵不利,导致了产率问题。[4][4+4]光环加成反应首先从一个1,3-二烯体系的光激发开始。一分子激发态共轭二烯中最高占据分子轨道(HOMO)的轨道对称性与另一分子基态二烯中最低未占据分子轨道(LUMO)的轨道对称性相同,因此它们能形成激基复合物。随后该激基复合物衰变闭环形成了环辛烷结构。
立体化学
[编辑][4+4]环加成反应中的立体化学控制并不常见,但确实存在,如某些交联技术可以成功实现Enol-exo立体选择性。[5]

除个别特例外,通过使用现有立体中心来控制形成桥头碳原子的立体构型基本上无法实现。[6]
有机合成应用
[编辑][4+4]环加成反应常和[2+2]环加成反应竞争,因此[4+4]环加成的实际应用很少。但若当该反应有一定产率时,此法可用于一步构建具有复杂立体中心的八元环结构,如2000年Yong-gyun Lee、Kevin F. McGee等拟议的对紫杉醇的合成[7]与对岩藻球菌素家族分子的合成[8]。另外,尽管该反应首先形成了稠环,但随后可裂解形成大环。[9]
![通过[4+4]环加成反应合成紫杉醇中八元环的方案](http://upload.wikimedia.org/wikipedia/commons/thumb/c/cf/Key_step_building_the_BC_rings_of_Taxol_in_a_proposed_synthesis.svg/720px-Key_step_building_the_BC_rings_of_Taxol_in_a_proposed_synthesis.svg.png)
在紫杉醇八元环部分合成中,通过[4+4]环加成反应进行环构架建立只需利用一个相对线性且简单的2-吡啶酮衍生物,将其折叠成环便可得到所需的稠合环,产物C3、C8和C15(相较紫杉醇)立体构型符合预期,并且环上两个双键可接受反式加成。预期该产物内酰胺环的开环与进一步官能团化将产生紫杉酚。[7]

同样,使用该反应可以快速构建具有5-8-5环系统的岩藻球菌素家族分子。尽管该反应形成反式异构体的立体选择性高,使其不适合目标分子的后续合成,但其容易产生四个三级手性中心的特性仍引人关注。[8]
![十一元[5+8]稠环的构建](http://upload.wikimedia.org/wikipedia/commons/thumb/3/38/Eleven-membered_ring_form_4%2B4_photocycloaddition.svg/720px-Eleven-membered_ring_form_4%2B4_photocycloaddition.svg.png)
[4+4]环加成反应并不局限于构建八元环。只要通过连接环网,然后断开并环共用的共价键,就可以实现预置了立体中心的宏环的合成。
局限性
[编辑][4+4]环加成反应不可避免地带有[2 + 2]环加成反应的副产物。但由于反应可逆,可以通过热力学控制形成较稳定的产物。[10]
![[4+4]环加成反应副反应的发生](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7d/Cisfused5-8ringconstruction.svg/500px-Cisfused5-8ringconstruction.svg.png)
参见
[编辑]参考文献
[编辑]- ^ Fieser, Louis F.; Lothrop, Warren C. The Structure of Anthracene. J. Am. Chem. Soc. 1936, 58: 749–753. doi:10.1021/ja01296a016.
- ^ Heiko, I.; Luo, J. The reversible [4+4] photocycloaddition of acridizinium derivatives. J. Photochem. Photobiol., A. 2008, 200: 3–9. doi:10.1016/j.jphotochem.2008.04.008.
- ^ Zhu, M.; Qiu, Z.; Hiel, G.; Sieburth, S. Photocycloaddition of Four-Carbon-Tethered Pyridones. Intramolecular Hydrogen Bonding and Facilitated Amide Hydrolysis by a Proximal Secondary Alcohol.. J. Org. Chem. 2002, 67: 3487–3493. doi:10.1021/jo025565n.
- ^ Wender, P.; Smith, T. Transition Metal-Catalyzed Intramolecular [4+2] Cycloadditions: Mechanistic and Synthetic Investigations. Tetrahedron. 1998, 54: 1255–1275. doi:10.1016/S0040-4020(97)10223-X.
- ^ Lei, L.; Benderb, J.; West F. G. Diastereocontrol in [4+4]-photocycloadditions of pyran-2-ones: effect of ring substituents and chiral ketal. Tetrahedron Lett. 2009, 50: 1188–1192. doi:10.1016/j.tetlet.2008.12.117.
- ^ Song, D.; McDonald, R.; West, F. G. Diastereoselective [4+4]-photocycloaddition reactions of pyran-2-ones: rapid access to functionalized 5-8-5 skeletons. Org. Lett. 2006, 8: 4075–4078. doi:10.1021/ol061576h.
- ^ 7.0 7.1 Lee, Y.-G.; McGee, K. F.; Chen, J.; Rucando, D.; Sieburth, S. McN. A [4+4] 2-Pyridone Approach to Taxol. 3. Stereocontrol during Elaboration of the Cyclooctane. J. Org. Chem. 2000, 65: 6676–6681. doi:10.1021/jo005532c.
- ^ 8.0 8.1 McGee, K. F.; Al-Tel, T. H.; Sieburth, S. McN. Fusicoccin Synthesis by Intramolecular [4+4] Photocycloaddition of 2-Pyridones: Stereocontrol of the Cycloaddition and Elaboration of the Pentacyclic Product. Synthesis. 2001, 112: 1185–1196. doi:10.1055/s-2001-15066.
- ^ Sieburth, S. McN.; Al-Tel, T. H.; Rucando, D. Beyond the medium ring: A [4+4] Cycloaddition/Fragmentation Synthesis of Eleven-membered Rings. Tetrahedron Lett. 1997, 38: 8433–8434. doi:10.1016/S0040-4039(97)10272-6.
- ^ Sieburth, S. McN.; Cunard, N. T. The [4+4] cycloaddition and its strategic application in natural product synthesis. Tetrahedron. 1996, 52: 6251–6282. doi:10.1016/0040-4020(95)01077-7.
