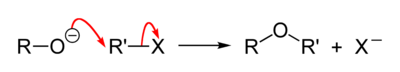
威廉姆逊合成反应
外观
威廉姆逊合成(Williamson合成)是制备混合醚的一种方法。是由卤代烃与醇钠或酚钠作用而得。是一种双分子亲核取代反应(SN2)。最早由亚历山大·威廉·威廉姆逊发表于英国化学会志J.Chem.Soc.1852年第4卷第229页[1]。
威廉姆逊合成法中只能选用伯卤代烷与醇钠为原料。因为醇钠既是亲核试剂,又是强碱,仲、叔卤代烷(特别是叔卤代烷)在强碱条件下主要发生消除反应而生成烯烃。
其反应使用的碱取决于醇羟基的酸性,若醇是烷基醇类(羟基酸性弱)则一般都是较强的碱,比如NaH, KH, LDA, LHMDS, NaHMDS等;而针对酚羟基这种强酸性羟基,则可以使用Na2CO3, K2CO3这样较弱的路易斯碱; 而有些反应甚至可以直接使用Na, K这类金属进行氢的置换制备醇负离子。
其反应溶剂一般使用DMF,DMSO这类非质子极性溶剂,若使用乙醇一类的质子极性溶剂则非常容易让卤代烃发生消除反应。
其反应活性为:烷基活性:甲基> 烯丙基、苄基 > 一级碳 > 二级碳。 三级碳由于非常容易消除而很难进行取代反应。 离去基团活性: OTs、 I > OMs > Br > Cl
当反应进程中有Cu以及其盐(比如CuI)参与时,就可以合成芳香醚类(Ullmann 反应)
醇羟基在碱性条件下形成醇负离子,进攻卤代烃的碳正中心,卤代烃脱去卤素形成醚键。反应条件为碱性,高浓度碱,高温对反应有利;水份对反应不利[2]。
参考资料
[编辑]| 这是一篇關於化學反應的小作品。您可以通过编辑或修订扩充其内容。 |